Это независимый от ориджина, но зависимый от рекомбинации процесс. Впервые был изучен на примере репликации фага Т4. В последних исследованиях стало понятно, что при этом механизме один конец ДНК проникает в ДНК-матрицу и образует репликативную вилку. Внеплановый синтез ДНК наблюдается как при репарации DSBs, так и при восстановлении вилки репликации. Подобная же модель применена для объяснения восстановления DSBs у дрожжей, когда более проксимальная от центромеры часть плеча хромосомы реплицируется путем BIR. В гаплоидном геноме этот процесс может приводить к нереципрокным транслокациям в торм случае, если спаривание произойдет в неаллельном участке (а в аллельно оно произойти не может из-за его отсутствия).По этому же механизму может идти встраивание линейной ДНК в неповрежденное плечо хромосомы дрожжей. В опухолевых клетках млекопитающих этот процесс приводит к удлинению теломер в отсутствие теломеразы.
На рис…показана схема репликации, индуцированной разрывами в сравнении с генной конверсией.
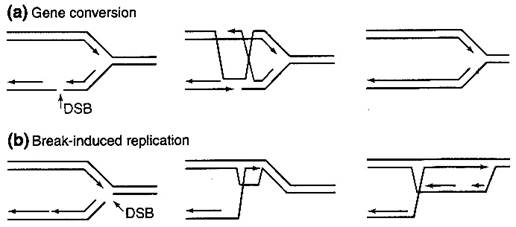
Рис….Генная конверсия и репликация, индуцированная разрывами ДНК
Генная конверсия.
Модель репарации DSBs, предложенная Шостаком, предполагает внедрение в матрицу двух 3’- концов, образования структур Холлидея, разрешение которых может идти как по кроссоверному, так и по некроссоверному типу. По этой модели вновьсинтезированная ДНК является полуконсервативной, то есть вновь синтезированная ДНК присутствует и в донорной и в реципиентной ДНК. Этот механизм, впрочем, не нашел своего подтверждения в экспериментах, во-первых, так как кроссоверные обмены являются крайне редкими, что говорит о том, что Холлидеевские структуры разрешаются преимущественно без обмена нитей, или просто крайне редки, или даже вовсе не формируются. Во-вторых, гетеродуплексная ДНК, появляющаяся в результате неполного спаривания донорной и реципиентной ДНК редко обнаруживается у донора, но часто – у реципиента. Этот второй факт нельзя было предположить, исходя из того, что после того, как произошла расчистка разрыва, а затем спаривание и синтез, при этом ДНК осталась «неисправленной». В-третьих, если зона рекомбинации содержит ДНК-повторы, то более 50% участков генной конверсии содержат их измененное (увеличенное или уменьшенное) количество копий, причем все эти изменения затрагивают реципиентную ДНК. Исходя из этих противоречий было предложено несколько моделей зависимого от синтеза ДНК отжига нитей (synthesis-dependent strand annealing, SDSA).
SDSA может осуществляться и по модели Шостака – две полуконсервативные отреплицированные нити могут открутиться от их доноров и взаимно отжечься. В этом случае вся новосинтезированная ДНК оказывается в локусе реципиента, Холлидеевские структуры разрушаются за ненадобностью. Это хорошо согласуется с тем, что измененное число повторов встречается только в реципиентной ДНК.
Напротив, Насиф предполагает, что новосинтезированная нить продолжает наращиваться за счет передвижения небольшого «пузырька» репликации, вроде того, что наблюдается при мсследовании репликации «in vitro». Обычно вновь синтезированная нить отжигается со вторым концом DSB. Но Фергюссон и Холман показали, что это второй конец сам может формировать «пузырек» репликации, и таким образом приводить к появлению Холлидеевской структуры, разрешающейся путем кроссинговера. Пропорция кроссоверных событий зависит от того, как часто формируются эти альтернативные структуры.
Захват репарационно-репликационной вилки.
BIR и генная конверсия – тесно связанные процессы. При генной конверсии, как и в случае BIR, все начинается с внедрения в донорную ДНК одного конца DSB. Это внедрение формирует репликативную вилку, и на обеих нитях – отстающей и ведущей – начинается синтез ДНК. Генная конверсия произойдет, если вилка захватит второй конец DSB, который может отжечься или с перемещающейся матрицей движущейся репликативной вилки, или с вновь синтезированной нитью, если она открутится от вилки репликации. В последнем случае не произойдет никакого кроссинговера, в первом – разрешение может пройти как по кроссоверному, так и по некроссоверному типу. Если в процессе митоза второй конец разрыва утрачен или деградирован (как на концах хромосом в клетках, утративших теломеразу) – то происходит BIR. Из этого следует, что если митоз пройдет до того, как разрыв отрепарируется, то бесцентромерный участок будет утерян.Оставшаяся укороченная хромосома может быть в последствие восстановлена только путем BIR. Недавно было показано, что вилка репликации при репарации ДНК включает в себя ДНК-полимеразы как ведущей, так и отстающей нитей и множество сопутствующих факторов. Хотя вилка репликации при рекомбинации может не содержать некоторых факторов, например, ДНК-геликаз, связанных с ориджинами репликации. Это может объяснить то, почему репаративная репликация часто приводит к перемещению вновь синтезированной нити и почему генная конверсия у дрожжей не приводит к синтезу протяженных участков ДНК (более 10 кб), длина, не являющаяся проблемой для нормальной вилки репликации. Многие наблюдения подтверждают, что обе вновь синтезированные нити ДНК откручиваются от матриц и отжигаются друг с другом в реципиетном локусе. Это требует участия геликаз в перемещении нити, причем эти геликазы должны быть подобны RuvAB E.coli, связывающейся с холлидееевской структурой и способствующей ее разрешению. Белки RuvAB играют важнейшую роль в ориджин-независимом, рекомбинационно-зависимом синтезе ДНК. Конечно, механизм репарации DSBs, основанный на захвате репарационно-репликационной вилки, может осуществляться одним или несколькими различными описанными ниже путями. Выбор пути зависит от степени совершенства гомологии донора и реципиента.
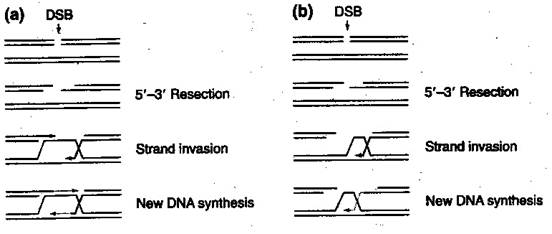
Генетическая характеристика белков, вовлеченных в гомологическую рекомбинацию.
Наши знания базируются в первую очередь на изучении бактерий и бактериофагов, главный белок рекомбинации – RecA.
У эукариот есть несколько эволюционно консервативных гомологов RecA, способных катализировать обмен нитями ДНК. Один из гомологов – Rad51, экспрессируется во всех клетках, другой Dmc1 – только в мейотических. Оба эти белка способны к переносу нити и переключению спаривания, их свойства подобны, но не идентичны RecA. Эукариоты без Dmc1 имеют тяжелые дефекты мейотической рекомбинации. В соматических клетках позвоночных Rad51 необходим для клеточного роста, и исследования показывают, что множество повреждений хромосом являются результатом DSBs, появившихся при репликации ДНК. Вопреки собственной универсальности, Rad51 не является необходимым для всех форм DSBs-индуцированной рекомбинации у дрожжей. Он необходим, как и Rad52, для процессов генной конверсии, происходящей с вовлечением двух гомологичных хромосом. Для других DSBs-индуцированных процессов он не столь необходим, например BIR может спокой но протекать в его отсутствии, но не в отсутствии Rad52. Как внедрение нити и старт ДНК-репликации протекают в отсутствии Rad51, остается загадкой. Мутантный фенотип Rad51 сходенс таковым для Rad54, Rad57 и Rad55.
Самым важным для рекомбинации у дрожжей является белок Rad52, кране консервативный эволюционно у эукариот, но не у бактерий. При его отсутствии у дрожжей не идет никаких рекомбинационных процессов. У высших позвоночных напротив, он не столь важен, как Rad51. Но, может быть, существуют какие-то его пока неизвестные гомологи. Например, у S.pombe есть два его гомолога, и только нокаут по обоим является летальным – клетки остаются заблокированными в S-фазе. У C.elegans нет гомолога Rad52. гомолог Rad52 - Rad59 у дрожжей может вести несколько типов Rad51-независимой рекомбинации. Rad57 и Rad55 имеют большую гомологию с Rad51. Их мутации выявляют рекомбинационные дефекты при низкой температуре, но этот дефект может быть скорректирован оверэкспрессией Rad51. Вероятно, эти белки могут служить факторами поддержки для Rad51 при загрузке на ДНК, как RecFOR у прокариот. В клетках позвоночных есть также большое количество белков с некоторой гомологией с Rad51 – Rad51B, Rad51C, XRCC2, XRCC3. Эти белки играют свою роль в репарации, вероятно, подобную таковой Rad57 и Rad55 у дрожжей.
Rad54 является членом обширного Swi/Snf2 семейства хроматин-ремоделирующих белков. Он имеет некоторую геликазную активность, но его точная роль в рекомбинации недостаточно ясна. Как и у дрожжей, у позвоночных его отсутствие приводит к повышенной радиочувствительности, вероятно в результате нарушения сродства к матрице. У дрожжей есть его гомолог Tid1 (Rdh54), влияющий на рекомбинацию между гомологичными хромосомами и не влияющий на таковую сестринских хроматид, что вызывает некоторые реминисценции с ролью Dmc1 в мейозе. Для рекомбинации двойной мутант по этим гомологам столь же тяжел, как Rad52.
Биохимические свойства белков гомологической рекомбинации.
Наиболее важный белок Rad52 образует мультимерные (гексамерные) кольца, которые одновременно связывают концы и ведут отжиг. У человеческого Rad52 те же свойства. Rad52 связывается с Rad51, способствуя обмену нитей. Rad52 также связывается с RPA, необходимого для репликации ДНК. Интересно, что есть специальные мутации большой субъединицы этого комплекса, которые подавляет и генную конверсию и отжиг нитей, но не влияют на репликацию.
Rad51 и Rad52 белки взаимодействуют с множеством других белков Rad54, гетеродимером Rad55\Rad57. Ни один из этих белков не участвует в негомологическом воссоединении концов.
Любые стандартные опыты по изучению RecA/ Rad51 опосредованному обмену нитей связаны с введением двунитевого фрагмента ДНК к однонитевому ДНК кольцу, покрытому белком Rad51. В различных комбинациях с другими белками Rad51 проводит обмен нитей in vitro.
In vitro, человеческий и дрожжевой Rad51 образуют на однонитевой ДНК филамент, который может взаимодействовать с гомологической дуплексной ДНК. При этом филамент удлиняет двунитевую ДНК на 50% - то есть растягивает ее, причем может быть организовано два различных вытянутых состояния в зависимости от связывания с дезоксирибозой. Смена этих двух вытянутых состояний может, вероятно, быть двигателем обмена нитей, связанного с перемещениями Rad51 внутри филамента.
Наблюдение рекомбинации in vivo.
Образование фокусов Rad51 во время мейоза. Это, вероятно, места рекомбинации. Делеции Rad52, Rad55, Rad57 предотвращают их образование как при нормальном мейозе, так и после γ-облучения.
Анализ температур-чувствительных мутантов ДНК-полимераз и факторов PCNA и RFC показывает, что они тоже необходимы для рекомбинации. Также оказалось, что для репарации DSBs совершенно необходима ДНК-полимераза-α-праймаза, то есть нормальный синтез ДНК на обеих нитях.
Изучение рекомбинации безусловно будет продолжаться и принесет свои плоды.(например, как останавливать опухолевые клетки, делящиеся без активации теломеразы).
 2015-04-12
2015-04-12 919
919







