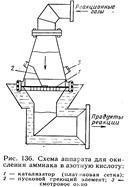
 В тех случаях, когда реакция протекает практически мгновенно, при контакте с поверхностью катализатор удобно использовать реакторы с катализаторными сетками. В реакторе этого типа проводят, например, окисление аммиака в азотную кислоту. Конструктивно он выполнен весьма просто. В цилиндрической части корпуса аппарата закреплена платиновая сетка, служащая в этом процессе катализатором. Реакционные газы подаются сверху, их температура доведена до необходимой для реакции в специальном теплообменнике. В моменты пуска реактора сетка разогревается до температуры реакции греющим электрическим элементом. Большинство химических реакций, осуществленных в промышленности, протекают во времени, поэтому в реакторе необходимо создать такие условия, при которых реагирующие друг с другом газы находились бы в контакте с катализатором в течение времени, близкого к необходимому.
В тех случаях, когда реакция протекает практически мгновенно, при контакте с поверхностью катализатор удобно использовать реакторы с катализаторными сетками. В реакторе этого типа проводят, например, окисление аммиака в азотную кислоту. Конструктивно он выполнен весьма просто. В цилиндрической части корпуса аппарата закреплена платиновая сетка, служащая в этом процессе катализатором. Реакционные газы подаются сверху, их температура доведена до необходимой для реакции в специальном теплообменнике. В моменты пуска реактора сетка разогревается до температуры реакции греющим электрическим элементом. Большинство химических реакций, осуществленных в промышленности, протекают во времени, поэтому в реакторе необходимо создать такие условия, при которых реагирующие друг с другом газы находились бы в контакте с катализатором в течение времени, близкого к необходимому.
БИЛЕТ №7
Графическое представление изменения состояния системы при химическом превращении. Эндо- и экзотермические реакции. Влияние катализатора на энергетическое состояние химической реакции. Основные законы формальной кинетики: уравнение Аррениуса, закон действующих масс.
1- путь реакции без катализатора
2- путь каталитической реакции
Энергетический уровень: I- исходных веществ
II- продуктов реакции
Пусть протекает одностадийная реакция с Е0:
А+В→ R
Ход этой реакции на кривой изображен 1. Присутствие катализатора механизм реакции меняется, и она протекает через несколько стадий - 2 стадия.
Первой стадией является образование промежуточного активированного комплекса:
А+К→АК
Затем активированный комплекс взаимодействует со вторым компонентом с образованием комплекса катализатора и продукта
АК+В→RК
Последней стадией является разложение комплекса с образованием продукта R и высвобождением катализатора для нового каталитического комплекса
RК  R+К
R+К
Каждая из этих последовательных стадий характеризуется своими значениями энергиями актив Е1, Е2, Е3, но высота каждого из этих потенциальных барьеров ниже Е0. Т.о., в присутствии катализатора реакция протекает энергетически по более выгодному пути, что позволяет её проводить при большей скорости. Однако исходное и конечное состояние системы (I и II) в присутствии катализатора и без него одинаковы. Следовательно, роль катализатора состоит в изменение скорости достижения состояния равновесия.
Чтобы молекулы начали превращаться необходимо определенная энергия для преодоления потенциального барьера.
Конфигурация промежуточных комплексов похожа на конфигурацию веществ в реакционной смеси, к которому он ближе по энергии Гиббса. Для экзотерм. реакции промежуточный комплекс по строению схож с исходными веществами, а для эндот. – с продуктами реакции.
Закон действующих реакций:
скорость простой элементарной реакции прямо пропорциональна концентрации реагирующих веществ в соответствующих степенях, называемых порядком реакции
2А+В→ R
W=k[A]2[B]
Константа скорости реакции, как правило, резко увеличивается с ростом Т.
 2015-04-17
2015-04-17 1223
1223

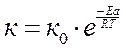 -
-