СОДЕРЖАНИЕ
| Тема 1 | Горение - основной процесс на пожаре, физико-химическая природа процессов горения и взрыва, их классификация……………………………………………… | |
| Лекция № 1 | Горение – основной процесс на пожаре …………………… | |
| Лекция № 2 | Пламя и его распространение в пространстве …………….. | |
| Тема 3 | Материальный и тепловой баланс процессов горения... | |
| Лекция № 3 | Материальный баланс процессов горения …………………. | |
| Лекция № 4 | Тепловой баланс процессов горения ……………………….. | |
| Тема 4 | Самовоспламенение и самовозгорание ………………….. | |
| Лекция № 5 | Самовоспламенение …………………………………………. | |
| Лекция № 6 | Самовоспламенение и самовозгорание …………………….. | |
| Лекция № 7 | Самовозгорание ……………………………………………… | |
| Тема 5 | Вынужденное воспламенение (зажигание парогазовых горючих систем) | |
| Лекция № 8 | Вынужденное воспламенение (зажигание) | |
| Тема 6 | Горение газопаровых и пылевоздушных смесей ………. | |
| Лекция № 9 | Горение газопаровых и пылевоздушных смесей ………….. | |
| Лекция № 10 | Ударные волны и детонация | |
| Литература |
Тема 1. Горение - основной процесс на пожаре, физико-химическая природа процессов горения и взрыва, их классификация.
Лекция №1. Горение – основной процесс на пожаре.
Цель лекции: объяснить студентам механизм химических и физических явлений, протекающих при горении, который является основным процессом на пожаре.
План лекции
Введение (исторический обзор науки о горении, предмет ее
изучения, связь с другими дисциплинами)
1. Определение горения
2. Механизм химических реакций при горении
3. Влияние различных факторов на скорость химических реакций
при горении
4. Основные процессы, происходящие при горении
ВВЕДЕНИЕ
Огонь – это явление природы, которому во многом люди обязаны развитию своей цивилизации, начиная с раннего периода истории человечества. Археологи установили, что люди стали пользоваться огнем 600000 лет назад, а научились получать огонь около 30000 лет назад. С огнем связаны многие ранние мифы и легенды. Нельзя не вспомнить миф о Прометее, похитившем огонь у богов и отдавшем его людям.
Огонь был первым источником энергии первобытного человека. По мере эволюции человек эмпирически познавал процессы горения, находил и применял новые виды горючего, открывал термические процессы, протекающие под воздействием теплоты горения, необходимые ему для удовлетворения своих нужд – приготовления пищи, выплавке металлов, изготовлению керамики, стекла и многое другое. Без применения процессов горения человечество так и осталось бы в каменном веке, после которого никогда бы не наступил ни бронзовый, ни железный век.
Поэтому огонь привлекал внимание ученых, начиная с глубокой древности. Так еще в V веке до н.э. Эмпедокл утверждал, что существуют 4 начала всех вещей – огонь, воздух, вода и земля, считая их материальными субстанциями. Возможно, такие представления были заимствованы им из древнеиндийских и древнекитайских философских учений.
В IV веке до н.э. древнегреческий философ Аристотель, признавая эти; начала, дополнил их пятым принципом – «существо», но он считал их не материальными субстанциями, а лишь носителями некоторых основных свойств веществ, ощущаемых человеком при помощи осязания: теплоты, холода, сухости, влажности.
Долгое время представления об огне и горении оставались столь же наивными с точки зрения современной науки.. Так в XIII веке Фома Аквинский утверждал, что, если тело подвергается действию огня, то оно становится горячим, принимая на некоторое время «форму тепла» и в зависимости от того, восприняло ли оно эту форму полностью или нет, тело охлаждалось при удалении огня или улавливало огонь и т.о. могло передавать эту форму другим телам.
Развитие цивилизации требовало все больше энергии, получалась, в основном, за счет сжигания древесины, запасы которой были не безграничны. Жизнь ставила вопросы о более рациональной организации горения. Кроме того, расширялась выплавка различных металлов путем обжига руд, которая также была малоэффективной из-за образования большого количества окалины.
К концу XVII века стала отчетливо проявляться потребность свести многообразные изменения веществ, которые происходят в процессе горения, к одному общему принципу.
Это обусловило то, что в XVII веке немецким ученым Георгом Шталем была создана теория флогистона, установившая глубинную связь между процессами горения и окисления. Флогистон (термин происходит от греческого слова  - горючий) – некоторый абстрактный принцип горючести, который становится «горючей субстанцией» только тогда, когда находится в сложном теле в сочетании с другими веществами. Шталь предполагал, что при нагревании сложных тел флогистон улетучивается и, соединяясь с воздухом воспламеняется. Однако этому противоречили факты об увеличении массы металлов при их нагревании на воздухе, поэтому последователи флогистона объясняли это тем, что флогистон имеет отрицательный вес, поэтому при прокаливании металлов в воздухе, когда удаляется флогистон, остаток обжигаемого металла становится более тяжелым.
- горючий) – некоторый абстрактный принцип горючести, который становится «горючей субстанцией» только тогда, когда находится в сложном теле в сочетании с другими веществами. Шталь предполагал, что при нагревании сложных тел флогистон улетучивается и, соединяясь с воздухом воспламеняется. Однако этому противоречили факты об увеличении массы металлов при их нагревании на воздухе, поэтому последователи флогистона объясняли это тем, что флогистон имеет отрицательный вес, поэтому при прокаливании металлов в воздухе, когда удаляется флогистон, остаток обжигаемого металла становится более тяжелым.
Несмотря на все отмечаемые противоречия, теория флогистона просуществовала более 100 лет. А.Лавуазье отмечал, что она получила столь широкое распространение потому, что на ее основе были сделаны два важных открытия. Одно из них состоит в установлении факта, что металлы – тела горючие и превращение их в окалины представляет явление горения, второе - в том, что свойство гореть или быть воспламеняемым может передаваться от одного тела к другому.
В середине XVIII века в эпоху господства теории флогистона М.В.Ломоносов был первым ученым, подвергшим основательной и аргументированной критике теорию флогистона. Он впервые показал, что горение – это реакция химического взаимодействия с воздухом.
В дальнейшем практически одновременно с Дж.Пристли и К.В.Шееле А.Лавуазье получил кислород, установил его химическую природу и способность соединяться с фосфором и серой при горении и металлами при окислении, правильно объяснил процессы горения и окисления и создал основы кислородной теории.
А.Лавуазье впервые установил, что воздух имеет сложный состав и состоит из «живительного» воздуха (кислорода) и инертной его части (азота), которая не поддерживает горение и не пригодна для дыхания. В 1777 году в мемуарах «О горении вообще» он дал следующее определение явления горения:
«Первое явление. При всяком горении происходит выделение огненной материи или света.
Второе явление. Тела могут гореть только в очень немногих видах воздуха или, вернее, горение может происходить в одном виде воздуха,… который я буду называть «чистым воздухом». Тела, которые мы называем горючими, не только не горят в пустоте или каком-либо другом воздухе, но там они гаснут так быстро, как если бы их погрузили в воду или любую другую жидкость.
Третье явление. При всяком горении происходит разрушение или разложение чистого воздуха, и вес сгоревшего тела увеличивается точно на количество поглощенного воздуха.
Четвертое явление. При всяком горении горящее тело превращается … в результате прибавления того вещества, которое увеличивает его вес…».
Дальнейшие исследования процессов горения проводили многие ученые. М.Фарадей по результатам своих исследований опубликовал книгу «История свечи», переведенную на многие языки. В том же XIX веке исследованием температуры и скорости распространения пламени занимался Р.В.Бунзен. А.Л.Ле-Шателье совместно с П.Э.М.Бертло и Ф.Малларом изучали процессы воспламенения, горения, взрывов и детонации и впервые сделали попытку рассчитать скорость горения. Так начиналось развитие современной теории горения и взрыва.
Выдающийся вклад в развитие теории горения и взрыва внесли представители русской школы горения. Русский ученый В.А.Михельсон в 1890 г. открыл закон распространения пламени, носящий его имя и заложил основы тепловой теории взрывного горения.
Теория автоокисления, разработанная русским академиком А.Н.Бахом, позволила объяснить самопроизвольно протекающие процессы окисления, являющиеся причиной самовозгорания различных веществ.
Работы академика Н.Н.Семенова по изучению механизма разветвленных цепных реакций и теплового самовоспламения (взрыва) являются выдающимся вкладом в мировую науку, за что он в 1956 году был удостоен Нобелевской премии. Теория цепных реакций горения позволяет объяснить механизм перехода обычного горения во взрывное, а также количественно оценить газовые взрывы. Академик Я.Б.Зельдович и профессор Д.А.Франк-Каменецкий создали теорию распространения пламени. Исследования наших ученых получили всемирное признание.
В современном обществе существует контролируемое горение, специально организованное человеком для удовлетворения своих потребностей в тепловой (печи, топки и т.п.), световой (свечи, керосиновые лампы, газовое освещение др.) и механической энергии (двигатели внутреннего сгорания, дизеля и т.п.) и неконтролируемое горение – пожары.
Но используя горение как источник энергии в своих целях, человек иногда становился и жертвой этого «джина, самим им выпущенного из бутылки» - пожаров. Поэтому изучение процессов горения, приобретение умений их регулирования и прекращения стало жизненно важной потребностью.
Ежегодно в России случается около 300000 пожаров. В огне гибнут около 20 тысяч человек и примерно столько же получают травмы. В мире на каждые 100 пожаров гибнет 1 человек, в России эта печальная статистика еще выше.
Пожар – это горение, способное самостоятельно распространяться вне специально предназначенного для этого места, приводящее к травмированию или гибели людей, уничтожению или повреждению имущества, ухудшению экологической обстановки.
Как следует из этого определения в основе всех явлений, протекающих на пожарах, лежит процесс горения, иногда сопровождающийся возникновением взрыва. Уяснить сущность процессов, происходящих на пожаре можно только на основе изучения теории горения и взрыва. Все сопутствующие явления – деформация и обрушение строительных конструкций, вскипание и выбросы и т.п. - являются следствием процесса горения.
В настоящее время продолжаются исследования процессов горения и взрыва, а также способов их предотвращения и прекращения во ВНИИПО (Москва) и Санкт-Петербургском филиале ВНИИПО, в Академии ГПС МЧС (Москва), в Санкт-Петербургском институте ГПС МЧС России, в испытательных пожарных лабораториях, в научно-исследовательских институтах и учебных заведениях.
1.Определение горения.
Как следует из самого определения пожара – основной процесс, протекающий на пожаре, это горение.
Поскольку процесс горения является сложным, однозначного определения горения нет, различные авторы предлагают собственные определения.
Д.А.Франк-Каменецкий горением называет протекание химической реакции в условиях прогрессивного самоускорения, связанного с накоплением в системе тепла или катализирующих продуктов реакции.
Горением также называют сложный физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимся превращением и сопровождающийся выделением большого количества тепла и света.
Однако в определенных условиях возникают так называемые холодные пламена, в которых химическая реакция протекает с умеренной скоростью и сопровождается свечением без заметного разогрева.
Горением называют физико-химический процесс, для которого характерны три признака: химическое превращение, выделение тепла, излучение света.
Другие авторы процессом горения называют сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем (кислородом воздуха), превращаясь в продукты горения, и который сопровождается интенсивным выделением тепла и световым излучением.
Различия в трактовке понятия горения вызваны направлением научных интересов авторов. На наш взгляд, практическим интересам сотрудников ГПС наиболее полно отвечает следующее определение горения:
Горение – это самоподдерживающийся сложный физико-химический процесс, основой которого являются быстропротекающие химические реакции окисления, сопровождающиеся выделением большого количества тепла и света.
Доминирующим процессом при горении является химическая реакция окисления, именно она влечет появление различных физических процессов: переноса тепла, переноса реагирующих веществ, излучения и др. Эти физические процессы развиваются по своим законам. Химические процессы окисления обладают большими потенциальными возможностями по скорости их протекания, но реальная скорость окисления при горении ниже, т.к. лимитируется скоростями физических процессов.
Химические реакции окисления в общем виде можно представить уравнением
aГор + bОк= 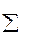 ni ПГi
ni ПГi
Где: Гор – горючее вещество,
Ок – окислитель,
ПГ – продукты горения.
a,b,ni – соответствующие стехиометрические коэффициенты.
При решении пожарно-технических задач при описании процессов горения обычно принимают «a» =1, при этом «b» может быть дробной величиной.
Тогда химические процессы при горении можно представить в виде
Гор + bОк= 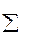 ni ПГi (1)
ni ПГi (1)
Но данное уравнение является лишь суммарным отражением, происходящих превращений. На самом деле химические реакции при горении являются многостадийными, а главное, цепными. Не разобравшись в механизме, происходящих процессов, невозможно понять причины распространения пламени, различие в его скоростях, величину температуры горения и др.
2.Механизм химических реакций при горении.
Акты химического превращения происходят при непосредственном контакте реагирующих компонентов (молекул, атомов, радикалов), но только в тех случаях, когда их энергия превышает определенный энергетический предел, называемый энергией активации Еа. Изобразим графически изменение энергии реагирующих компонентов (горючего и окислителя) и продуктов реакции при горении (рис.1.)
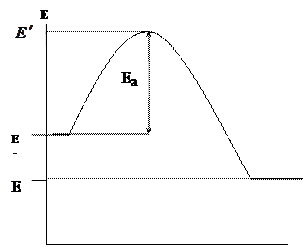 |
Рис 1. Изменение энергии реагирующих веществ и продуктов реакции при горении
По оси абсцисс изображен путь реакции горения, по оси ординат – энергия. 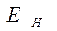 – средняя начальная энергия реагирующих компонентов,
– средняя начальная энергия реагирующих компонентов, 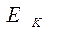 - средняя энергия продуктов горения.
- средняя энергия продуктов горения.
В реакцию горения будут вступать только активные частицы горючего и окислителя, которые будут обладать энергией, необходимой для вступление во взаимодействие, т.е. способные преодолеть энергетический барьер 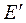 . Избыточная энергия активных частиц по сравнению со средней энергией
. Избыточная энергия активных частиц по сравнению со средней энергией 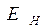 , называется энергией активации
, называется энергией активации 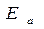 . Поскольку реакции, протекающие при горении являются экзотермическими
. Поскольку реакции, протекающие при горении являются экзотермическими 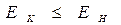 . Разность энергий образовавшихся продуктов горения и исходных веществ (горючего и окислителя) определяет тепловой эффект реакции:
. Разность энергий образовавшихся продуктов горения и исходных веществ (горючего и окислителя) определяет тепловой эффект реакции:
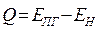
 |
Доля активных молекул возрастает при увеличении температуры горючей смеси.
На рис.2. изображено распределение энергий между молекулами при температуре 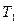 Если по оси энергий отметить значение, равное энергии активации
Если по оси энергий отметить значение, равное энергии активации 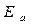 , то получим долю активных молекул в смеси при заданной температуре
, то получим долю активных молекул в смеси при заданной температуре 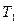 . Если под действием источника тепла температура смеси возросла до значения
. Если под действием источника тепла температура смеси возросла до значения 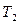 , то возрастет и доля активных молекул, а следовательно, и скорость реакции горения.
, то возрастет и доля активных молекул, а следовательно, и скорость реакции горения.
Однако существуют химические реакции, которые не нуждаются для своего развития в заметном предварительном подогреве. Это цепные реакции.
Основа теории цепных реакций – предположение о том, что исходные вещества превращаются в конечный продукт не сразу, а с образованием активных промежуточных продуктов
Продукт первичной химической реакции обладает большим запасом энергии, которая может рассеиваться в окружающем пространстве при соударении молекул продуктов реакции или за счет излучения, а может передаваться молекулам реагирующих компонентов, переводя их в активное состояние. Эти активные молекулы (атомы, радикалы) реагирующих веществ порождают цепь реакций, где энергия передается от одной молекулы к другой. Поэтому такие реакции называются цепными.

Химически активные молекулы, атомы, радикалы, образующиеся на элементарных стадиях цепной реакции – звеньях цепи- называются активными центрами. Большую часть активных центров составляют атомы и радикалы, которые наиболее реакционно способны. Но вследствие этого они и неустойчивы, т.к. могут вступать в реакции рекомбинации с образованием малоактивных продуктов.
Длина цепи, образуемая одним начальным активным центром, может достигать несколько сотен тысяч звеньев. Кинетические закономерности цепных реакций существенно зависят от того, сколько активных центров образуется в одном звене цепи. Если при участии исходного активного центра в результате образуется только один активный центр, то такая цепная реакция называется неразветвленной, если же в одном звене цепи образуются два или более активных центров, то такая цепная реакция называется разветвленной. Скорость разветвленных цепных реакций возрастает лавинообразно, в чем и состоит причина самоускорения химических реакций окисления при горении, так как для большинства из них характерен механизм разветвленных цепных реакций.
Практически любая реакция горения может иметь одновременно признаки и теплового и цепного механизма протекания реакции. Зарождение первых активных центров может иметь тепловой характер, а реагирование активных частиц по цепному механизму приводит к выделению тепла, разогреву горючей смеси и тепловому зарождению новых активных центров.
Любая цепная реакция складывается из элементарных стадий зарождения, продолжения и обрыва цепи.
Зарождение цепи является эндотермической реакцией. Образование свободных радикалов (т.е. атомов или групп атомов, имеющих свободные валентности, например, 
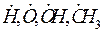 ) из молекул исходных веществ возможно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую смесь – инициирования.
) из молекул исходных веществ возможно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую смесь – инициирования.
Инициирование может осуществляться путем добавки специальных вещест – инициаторов, легко образующих свободные радикалы (например, пероксидов, химически активных газов 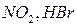 ), под действием ионизирующих излучений, под действием света – фотохимическое инициирование. Например, взаимодействие водорода с хлором
), под действием ионизирующих излучений, под действием света – фотохимическое инициирование. Например, взаимодействие водорода с хлором
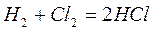
при обычных условиях протекает крайне медленно, а при сильном освещении (солнечным светом, горящим магнием) протекает со взрывом.
К реакциям продолжения цепи относятся элементарные стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к расходованию исходных веществ и образованию продуктов реакции.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
зарождение цепи:
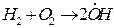
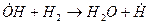
разветвление цепи:
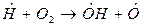
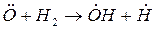
обрыв цепи:
гомогенный
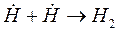
гетерогенный
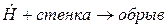
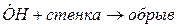
При развитии цепи, когда концентрация активных центров станет достаточно большой возможно образование такого звена, в котором активный центр прореагирует без генерации нового активного центра. Такое явление называется обрывом цепи.
Обрыв цепи может быть гомогенным и гетерогенным.
Гомогенный обрыв цепей возможен либо при взаимодействии радикалов или атомов между собой с образованием устойчивых продуктов, либо при реакции активного центра с посторонней для основного процесса молекулой без генерации новых активных центров.
Гетерогенный обрыв цепи происходит на стенках сосуда, где протекает реакция горения или поверхности твердых микрочастиц, присутствующих в газовой фазе, иногда специально вводимых (например, как при тушении порошками). Механизм гетерогенного обрыва цепей связан с адсорбцией активных центров на поверхности твердых частиц или материалов. Скорость гетерогенного обрыва цепей сильно зависит от соотношения площади поверхности стенок к объему сосуда, где происходит горение. Таким образом, уменьшение диаметра сосуда заметно снижает скорость реакции горения, вплоть до его полного прекращения. На этом основано создание огнепреградителей.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
зарождение цепи:
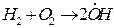
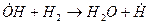
разветвление цепи:
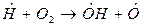
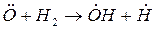
обрыв цепи:
гомогенный
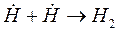
гетерогенный
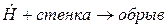
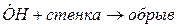
3.Влияние различных факторов на скорость химических реакций при
горении.
Зависимость скорости реакции горения от концентрации реагирующих веществ можно представить выражением
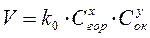 (2)
(2)
где: k0 – константа скорости реакции,
Сгор - концентрация горючего вещества, кмоль/м3,
Сок – концентрация окислителя, кмоль/м3,
x,y – порядки реакции по горючему и окислителю соответственно.
Как выше было сказано, суммарное уравнение реакции (1) не отражает истинного механизма протекания реакции горения, которая является многостадийной и, зачастую цепной, поэтому порядки реакции в уравнении (2) далеко не всегда совпадают с величиной стехиометрических коэффициентов в уравнении (1).
Отсюда следует, что чем больше концентрация горючего вещества, тем выше скорость горения.
Скорость реакции горения зависит от температуры:
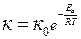 (3)
(3)
е – основание натурального логарифма
Еа – энергия активации, кДж/кмоль,
R – универсальная газовая постоянная, R=8,314 кДж/(К.кмоль)
Т – температура, К.
Это уравнение является выражением закона Аррениуса о зависимости скорости химических реакций от температуры. В упрощенном виде для узкого интервала температур можно пользоваться правилом Вант-Гоффа: скорость химической реакции возрастает в 2-4 раза при повышении температуры на каждые 100.
Таким образом, скорость химической реакции окисления горючего вещества при горении резко возрастает с повышением температуры, причем тем больше, чем ниже энергия активации.
Поскольку большинство реакций, протекающих при горении, являются обратимыми, то необходимо при описании их кинетики пользоваться константами равновесия. 
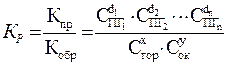 (4)
(4)
где: Кр – константа равновесия,
Кпр – константа скорости прямой реакции (окисления),
Кобр – константа скорости обратной реакции.
CПГ - концентрация продуктов горения
x,y,di –порядки реакции по горючему, окислителю и продуктам реакции соответственно.
Анализируя это выражение, можно сделать вывод о том, что скорость реакций окисления при горении зависит также от давления.
По принципу Ле-Шателье: при повышении давления равновесие смещается в сторону образования меньшего числа молей газоообразных веществ и соответственно в сторону уменьшения давления в системе. Если число молей газообразных продуктов горения значительно превышает число молей газообразных исходных веществ (горючих газов или паров и газообразного окислителя), то увеличение давления должно несколько тормозить процесс горения. Однако при этом не следует забывать о том, что увеличение давления приводит к возрастанию объемной концентрации горючих газообразных веществ и окислителя. А в соответствии с выражением (2) скорость реакций горения возрастает при повышении концентрации горючего вещества. На практике это приводит к тому, что при увеличении давления скорость реакций горения большинства веществ увеличивается.
При высоких давлениях возникают горячие пламена.
Как отмечалось выше, химические реакции окисления высокоэкзотермичны, поэтому горение сопровождается выделением большого количества теплоты и следовательно протекает при высокой температуре. Например, температура горения древесины 700-8000С, нефтепродуктов – еще выше – 1300-15000С.
При низких давлениях могут возникать так называемые холодные пламена. Самоускорение цепной химической реакции горения при этом происходит в изотермическом режиме. Это происходит при определенном составе горючей смеси и определенном состоянии среды. Изотермическое самоускорение характерно для смесей с достаточно высокой концентрацией активных, но достаточно стабильных промежуточных продуктов, что приводит к уменьшению разветвления цепей, а следовательно и к уменьшению выделения теплоты, которая за счет теплоотвода рассеивается в окружающую среду и частично затрачивается на нагрев стабильных промежуточных продуктов. Возникает свечение, представляющее собой хемилюминесценцию, а не тепловое излучение нагретых продуктов горения, которое имеет место в горячих пламенах.
Кроме того, на возникновение холодных пламен большое влияние оказывают стенки сосуда, в котором происходит горение. Они оказывают каталитическое влияние на процесс уничтожения активных центров, т.е. происходит гетерогенный обрыв цепи. Интенсивность этого процесса определяется скоростью диффузии активных центров к стенкам сосуда. Понижение давления способствует этому процессу. Понижение давления может не только привести к образованию холодных пламен вместо горячих, но в определенных условиях (например, в узких сосудах) даже к полному прекращению горения.
Как отмечалось выше, химические превращения в процессе горения приводят к возникновению различных физических процессов: переносу тепла за счет конвекции, теплопроводности и излучения, переноса реагирующих веществ и др.
Таким образом, горение можно характеризовать как сложный самоподдерживающийся физико-химический процесс, для которого характерны три признака: химическое превращение, выделение тепла и излучение (в том числе чаще всего и световое, т.е. в видимой части спектра). Отсутствие какого-либо из указанных признаков свидетельствует о том, что рассматриваемый процесс к горению не относится, например, «горение» электрической лампочки (отсутствует химическое превращение), коррозия металлов (отсутствует выделение света и практически незначимым является выделение тепла) и т.п.
4.Основные процессы, происходящие при горении.
Для возникновения процессов горения необходимо наличие горючего вещества и окислителя. Для инициирования возникновения горения необходимо наличие источника зажигания. Иногда горение может возникать самопроизвольно без источника зажигания (самовоспламенение и самовозгорание). Для возникновения горения должны быть соблюдены следующие условия:
- непосредственный контакт горючего и окислителя;
- горючее и окислитель должны находиться в определенных количественных соотношениях;
- источник зажигания должен обладать достаточной энергией.
При температурах, характерных для горячих пламен, а именно они возникают в подавляющем большинстве случаев на реальных пожарах, скорость химической реакции окисления при горении потенциально может быть очень высокой. Это вызвано тем, что согласно правилу Вант-Гоффа, при повышении температуры на каждые 100 скорость реакции увеличивается в 2-4 раза. Но скорость процесса горения в целом, зачастую, лимитируется ограниченной скоростью того или иного физического процесса, сопровождающего горение.
Основные физические процессы при горении – это тепло- и масообмен с окружающей средой за счет конвекции, диффузии и излучения.
При горении органических веществ образуются нагретые до высокой температуры летучие продукты горения: СО2,Н2О, СО и др. При горении некоторых неорганических веществ, например, некоторых металлов могут образовываться наряду с летучими и нелетучие продукты горения. Плотность летучих продуктов горения в 3-5 раз меньше плотности окружающего воздуха, поэтому над очагом горения существует конвективный (непрерывно поднимающийся вверх) поток горячей парогазовой смеси продуктов горения, сопровождающийся всасыванием свежего воздуха снизу к очагу горения. Эти процессы обуславливают массообмен (газообмен) и теплообмен очага горения с окружающей средой. Кроме того, теплообмен с окружающей средой осуществляется за счет теплового (невидимого инфракрасного) светового изучения, Лучистый поток распространятся во все стороны от зоны горения, в том числе и падает вниз на поверхность горящего вещества. Нагреваясь под воздействием лучистого теплового потока, горючее вещество испаряется или разлагается и испаряется с выделением горючих газообразных продуктов, которые, смешиваясь с воздухом, поступают в зону горения. Такое горение сопровождается образованием пламени.
Гомогенное горение – это процесс взаимодействия горючего и окислителя, находящихся в одинаковом агрегатном состоянии. Наиболее распространено гомогенное горение газов или паров в воздухе. Гомогенное горение характерно для всех газообразных и большинства жидких и твердых горючих материалов. Отличительным признаком такого горения является возникновение пламени над поверхностью конденсированного горючего вещества.
Гетерогенное горение - этогорение твердых горючих материалов непосредственно на их поверхности. Характерной особенностью гетерогенного горения является отсутствие пламени. Примерами его являются горение кокса, древесного угля, нелетучих металлов. Беспламенное горение в ряде случаев называют тлением.
Часто на пожарах гомогенное горение твердых горючих материалов на заключительной стадии после выгорания летучих веществ переходит в беспламенное гетерогенное догорание карбонизованных остатков (угля).
Лекция 2. Пламя и его распространение в пространстве.
Цель лекции: объяснить студентам механизм возникновения пламени и процессов его распространения, а также опасных факторов пожара им сопутствующих.
План лекции
1. Определение пламени и процессы в нем происходящие, виды и
режимы горения.
2. Распространение пламени в пространстве – дефлаграция и детонация.
3. Характеристика участников процесса горения.
4. Опасные факторы пожара и их воздействие на человека.
 2015-04-17
2015-04-17 4048
4048