В основе процессов горения лежат окислительно-восстановительные реакции. Уравнение реакции горения отражает конечный молекулярный или материальный баланс между горчим с окислителем и продуктами горения, т.е. является суммарной характеристикой процесса. При этом пути достижения горючей системой финального состояния могут быть различными. В конечном счете, они определяются механизмом химической реакции или последовательность молекулярных превращений, происходящих в пламени. Промежуточные молекулярные структуры часто являются неустойчивыми и носят название активных частиц или центров. Общим для реакций горения является то, что активные центры в подавляющем большинстве случаев являются свободными радикалами, т.е. молекулярными фрагментами, имеющими не спаренные электроны, по-другому говоря, свободные валентности. Такие фрагменты претерпевают ряд быстрых превращений (промежуточных реакций) на пути к конечному продукту горения. Химические превращения, протекающие по такому механизму, носят название цепные радикальные реакции. Впервые такое представление о способе протекания химических реакций было сформулировано немецким физико-химиком Базенштейном в 1913 г. для объяснения взрывного характера взаимодействия Cl2 c H2 при облучении светом. В дальнейшем для реакции
H2 +Cl2 = 2 HCl
Была экспериментально подтверждена следующая цепь актов возникновения и взаимодействия свободных радикалов:
1. 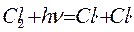 инициирование (зарождение) цепи
инициирование (зарождение) цепи
2. 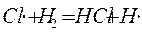
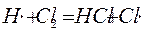 развитие цепи
развитие цепи
3. 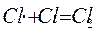
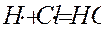
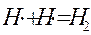 обрыв (гибель) цепи
обрыв (гибель) цепи
Во втором случае взаимодействие свободного радикала с молекулой Н2 или Cl2 приводит к образованию конечного продукта HCl и нового свободного радикала, который, в свою очередь, снова может взаимодействовать с исходными молекулами. Число таких взаимодействий может быть очень большим. Оно носит название -д лина цепи. Количество радикалов при этом не увеличивается.
Рассмотрим другой пример радикально-цепного механизма реакции:
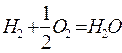
В этом случае возникновение свободных радикалов происходит при нагреве смеси по следующей эндотермической реакции:
1. 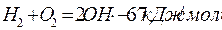
Далее происходит эндотермическое развитие цепи:
&ОН + Н2 ® Н2О + Н& + 44 кДж/моль,
но возможно и разветвление процесса
Н& + О2 ® &ОН + &О& - 54 кДж/моль,
&О& + H2 ® &ОН + Н&
Н& + О2 + Н2 ® 2&ОН + Н& - 42 кДж/моль.
То есть на каждой элементарной стадии процесса образуются один (продолжение) или два (разветвление цепи) радикала. Наконец, когда концентрация активных центров станет достаточно большой, все более вероятными становятся реакции обрыва цепи:
Н& + &ОН ® Н2О,
&ОН + Н& ® Н2О,
Н& + Н& ® Н2,
Н& + стенка ® обрыв,
&ОН + стенка ® обрыв.
Таким образом, взаимодействие Н2 с Cl2 является типичным неразветвленным радикальным цепным процессом, а термическое окисление водорода представляет собой непрерывную и разветвляющуюся цепь последовательных превращений, т.е. радикально-цепной процесс с разветвлением. Цепь сильно ветвится, и концентрация активных центров нарастает лавинообразно, т.е. реакция самоускоряется, что в конечном итоге приводит к самовоспламенению и взрыву.
В целом по аналогичному механизму, но несколько медленнее, протекают процессы окисления углеводородов, хотя в зависимости от вида горючего многие элементарные стадии будут различными. Окисление углеводородов обычно протекает по следующим типичным элементарным стадиям:
RH + О2 ® R& + НО2& зарождение цепи
R& + О2 ® ROO& (или R’-CH-OO&) продолжение цепи
т.е. образуется пероксидный радикал. Далее превращение этого радикала протекает по двум конкурирующим направлениям в зависимости от температуры. Так, при температурах ниже примерно 400 °С образуется гидропероксид:
ROO& + HR ® ROOH + R&
который далее распадается на два новых радикала:
ROOH ® RO& + &ОН вырожденное разветвление
При температурах выше 400 °С часть пероксидных радикалов изомеризуется и, распадаясь, превращается в альдегид:
R’-CH2-OO& ® R’-&CH-О-OH ® R’-CHO + &ОН
и далее - вырожденное разветвление:
R’-CHO + O2 ® R’-CO& +HO&
Вырожденное разветвление в первом случае протекает, как правило, при пониженных давлениях и может привести к возникновению так называемых "холодных пламен", тогда как при обычных и высоких давлениях цепь разветвляется по обоим механизмам и возникает "горячее" пламя. Горячие пламена от холодных отличаются также тем, что в них кроме конечных продуктов СО2 и Н2О в заметных количествах образуются оксид углерода СО, а также полиолефины, при термической деструкции которых получается сажа.
Характерной особенностью разветвленных цепных реакций является незначительное количество активных центров, появляющихся в результате инициирования. Основная их часть образуется в результате разветвления цепи. Таким образом, их концентрация n определяется не только скоростью начального инициирования цепи Wo, но и скоростью разветвления и обрыва цепей. Сумма этих трех скоростей представляет собой общую скорость образования активных центров. Тогда в дифференциальной форме выражение для скорости цепной разветвленной реакции окисления будет иметь следующий вид:
dn / dt = w0 + (f – g)×n, (1)
где Wo - скорость начального инициирования активных центров;
f - константа скорости разветвления цепи;
g - константа скорости обрыва цепи;
n - концентрация активных центров.
Скорость образования активных центров в начальной стадии зависит в известной степени от температуры и, в большей степени, от давления горючей смеси. Увеличение температуры повышает только скорость инициирования радикалов и скорость разветвления цепей. Скорость обрыва цепей от температуры не зависит, так как рекомбинация радикалов протекает без энергии активации. Изменение давления влияет, главным образом, на скорость обрыва цепей. При низких давлениях преобладает обрыв цепей на стенках сосуда, при высоких - в объеме горючей смеси.
Интегрирование уравнения (1) приводит к выражению:
n» wo/(f-g)×[exp(f-g)t-l], (2)
из которого видно, что через каждые t = 1/(f-g) сек концентрация радикалов n, а, следовательно, и скорость цепной реакции возрастает в е раз,
Если скорость разветвления цепи меньше скорости обрыва (f < g), то реакция протекает спокойно, как обычная цепная неразветвленная реакция (рис.1). Если же f > g, то в этом случае имеет место лавинообразное нарастание концентрации радикалов, а следовательно, и скорости самой реакции и за время порядка нескольких интервалов 1/(f-g) практически полное отсутствие реакции сменяется интенсивным протеканием процесса. Иными словами, после некоторого периода индукции происходит самовоспламенение смеси.
Период индукции - это начальный период реакции, в течение которого скорость реакции неизмеримо мала, и который далее сменяется периодом быстрого развития химического превращения. То есть период индукции - это период накопления активных центров
Таким образом, самоускоряющаюся реакция может развиваться пр. и постоянной температуре (ее влияние мы не рассматривали).
Условия протекания таких реакций характеризуются низкими давлениями 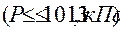 и температурами. Впервые это было показано Н.Н.Семеновым.
и температурами. Впервые это было показано Н.Н.Семеновым.
В этих случаях говорят о цепном самовоспламенении или цепном (изотермическом) взрыве. Однако чистый изотермический взрыв представляет редкое явление. Им, например, можно считать самовоспламение горючей смеси 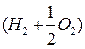 при давлениях в несколько миллиметров ртутного столба. В подавляющем большинстве случаев самовоспламенение наступает тогда, когда из-за большой скорости реакции выделяемое тепло может быть очень велико и скорость теплоотвода оказывается недостаточной. В итоге температура реакционной зоны, а следовательно и скорость реакции будут прогрессивно увеличиваться и реакция закончится взрывом. Взрыв в таких случаях называют тепловым.
при давлениях в несколько миллиметров ртутного столба. В подавляющем большинстве случаев самовоспламенение наступает тогда, когда из-за большой скорости реакции выделяемое тепло может быть очень велико и скорость теплоотвода оказывается недостаточной. В итоге температура реакционной зоны, а следовательно и скорость реакции будут прогрессивно увеличиваться и реакция закончится взрывом. Взрыв в таких случаях называют тепловым.
 2015-04-17
2015-04-17 4850
4850
