Для обратимой реакции первого порядка А ↔ R кинетическое уравнение имеет вид
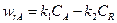 (13.18)
(13.18)
Выразив в уравнении (13.18)концентрации СА и СR через СА,0 и XA, получим
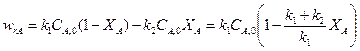
В условиях равновесия для обратимой реакции первого порядка имеет место равенство скоростей прямой и обратной реакции:
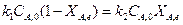
откуда следует, что
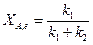 (13.19)
(13.19)
С учетом выражения (13.19) кинетическое уравнение обратимой реакции первого порядка примет вид
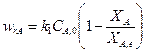 (13.20)
(13.20)
После подстановки выражения (13.20) в формулу (13.12) уравнение материального баланса можно представить в виде зависимости ХА от Т:
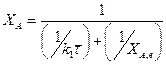 (13.21)
(13.21)
Уравнение (13.21), при ХА,е = 1 (т. е. для необратимой реакции первого порядка) переходит в уравнение (13.17).
Для графического решении системы уравнений материального и теплового балансов в случае обратимой реакции нужно построить график функции (13.21). График уравнения теплового баланса (13.15), не содержащего никаких кинетических параметров реакции и не зависит от вида кинетического уравнения.
В уравнении (13.21) от температуры зависят константа скорости прямой реакции k1 и равновесная степень преврашения ХА,е. Для обратимой эндотермической реакции (ΔH > 0) с ростом температуры увеличивается и константа равновесия, и равновесная степень превращения.
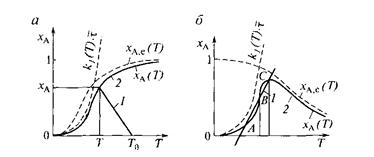
Рис. 13.5. Уравнения теплового (1) и материального (2)балансов для реактора идеального смешения при проведении в нем обратимых эндотермической (а) и экзотермической (б) реакций (совместное решение)
Величина ХА, рассчитанная по уравнению (13.21), при любых температурах будет меньше, чем k1 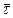 , и меньше, чем ХА,е, т.е. график функции ХА(Т) должен находиться на координатной плоскости (рис. 13.5, а) ниже графиков функций k1(Т)
, и меньше, чем ХА,е, т.е. график функции ХА(Т) должен находиться на координатной плоскости (рис. 13.5, а) ниже графиков функций k1(Т) 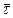 и ХА,е(Т).
и ХА,е(Т).
Система уравнений материального и теплового балансов для обратимой экзотермической реакции имеет такой же вид, как и для обратимой эндотермической реакции, т.е. это уравнения (13.21) и (13.15). Однако график функции ХА(Т) определяемый уравнением (13.21), будет другим. Связано это с тем, что равновесная степень превращения ХА,е, для экзотермических реакций с ростом температуры падает. Поэтому, построив график функции ХА(Т), пользуясь при этом теми же приемами, что и для обратимой экзотермической реакции, получим кривую с максимумом (рис. 13.5, б). Абсолютное значение максимума и его положение относительно кривой определяются, с одной стороны, средним временем пребывания реагентов в реакторе  , а с другой – состоянием химического равновесия.
, а с другой – состоянием химического равновесия.
Уравнение теплового баланса – прямая 1 с положительным тангенсом угла наклона. Эта прямая может пересекаться с кривой 2, отвечающей уравнению материального баланса, в одной или в нескольких точках (одно или несколько стационарных состояний).
Способы увеличения степени превращения реагентов при проведении реакций в адиабатическом реакторе идеального смешения.
В зависимости от начальных условий (температуры на входе Т0, начальной концентрации СА,0), соотношения объема аппарата и объемного расхода (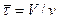 ), а также типа химической реакции в проточном реакторе идеального смешения устанавливается некоторое стационарное состояние, характеризующееся не изменяющимися во времени значениями температуры реакционной смеси и степени превращения на выходе из аппарата. Значения Т и ХА могут быть определены на основании совместного решения уравнений материального и теплового балансов, как это было показано выше.
), а также типа химической реакции в проточном реакторе идеального смешения устанавливается некоторое стационарное состояние, характеризующееся не изменяющимися во времени значениями температуры реакционной смеси и степени превращения на выходе из аппарата. Значения Т и ХА могут быть определены на основании совместного решения уравнений материального и теплового балансов, как это было показано выше.
В промышленных условиях очень важно наиболее полно использовать исходное сырье, т. е. достичь высоких значений степени превращения. Анализ получающихся решений позволяет найти условия проведения процесса, при которых достигается оптимальная степень превращения реагентов в адиабатическом реакторе идеального смешения.
Графическое решение системы уравнений материального и теплового балансов сводится к определению точки пересечения графиков функций ХА(Т), отвечающих обоим уравнениям. Более высокая степень превращения исходного сырья в адиабатическом реакторе соответствует на рис. 13.3÷13.5смещению точки пересечения в область больших значений ХА. Добиться этого можно, изменяя взаимное положение кривой, отвечающей уравнению материального баланса, и прямой, соответствующей уравнению теплового баланса. Разберем возможные способы влияния на изменение положения этих линий.
Для эндотермических реакций (обратимых и необратимых) повышения степени превращения можно добиться, прежде всего, увеличением начальной температуры Т0, что приведет к параллельному смещению вправо прямой 1 (рис. 13.3 и 13.5, а).
Для необратимых экзотермических реакций увеличение температуры на входе в реактор также приведет к росту степени превращения (рис. 13.4, прямая 2). Одновременно это позволит избежать тройного пересечения линий 2 и 4, отвечающего случаю множественности стационарных состояний. Однако увеличение начальной температуры должно быть оправдано экономическими соображениями, так как рост степени превращения будет сопровождаться при этом и увеличением затрат на нагрев исходной реакционной смеси.
Для обратимых экзотермических реакций, проводимых в адиабатическом реакторе идеального смешения, целесообразно добиться таких условий, чтобы решение системы уравнений материального и теплового балансов соответствовало точке максимума линии 2, отвечающего уравнению материального баланса (рис. 13.5, б). Смещение прямой 1 вправо, при возрастании начальной температуры, может привести не к увеличению, а к уменьшению степени превращения. Выбор оптимальных условий проведения обратимых экзотермических реакций представляет наибольшую сложность.
Другой способ изменения положения прямой, отвечающей уравнению теплового баланса, состоит в изменении угла ее наклона. Угловой коэффициент прямой, описывается уравнением (13.15)
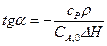
Его можно увеличить или уменьшить, изменив начальную концентрацию СА,0. В случае эндотермических реакций для повышения ХА, при условии сохранения прежней начальной температуры, увеличить крутизну прямой можно уменьшением СА,0 (однако это не всегда целесообразно, так как придется работать с низкими концентрациями реагентов). При проведении экзотермических реакций, увеличение СА,0, приведет к росту ΔТАД и прямая станет более пологой.
Повышение степени превращения ХА может быть достигнуто также при увеличении среднего времени пребывания 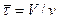 . Во всех рассмотренных случаях на графиках (рис. 13.3÷13.5) произойдет смещение влево линии, отвечающей уравнению материального баланса. При проведении обратимых реакций положение этой линии ограничено условиями равновесия [зависимость: ХА,е(Т) ]. Поэтому добиться увеличения ХА можно изменением условий, влияющих на равновесие.
. Во всех рассмотренных случаях на графиках (рис. 13.3÷13.5) произойдет смещение влево линии, отвечающей уравнению материального баланса. При проведении обратимых реакций положение этой линии ограничено условиями равновесия [зависимость: ХА,е(Т) ]. Поэтому добиться увеличения ХА можно изменением условий, влияющих на равновесие.
В каждом конкретном случае проводится анализ всех возможных способов увеличения степени превращения с проведением технико-экономического сравнения.
Стационарный неадиабатический реактор идеального смешения.
Для расчетов реактора идеального смешения, работающего в промежуточном тепловом режиме, пользуются полным уравнением теплового баланса (13.9)
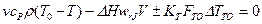
Движущей силой теплообмена между реакционной смесью, находящейся в реакторе, и теплоносителем (внешней средой) является средняя разность температур реакционной смеси и теплоносителя. Температура реакционной смеси Т одинакова в любой точке аппарата идеального смешения. Если считать, что средняя температура теплоносителя ТТ, то ΔТТО = | ТТ - Т |.
Рассмотрим случай экзотермической реакции в реакторе идеального смешения с отводом теплоты. Тогда ТТ < Т, и уравнение (13.9) с учетом уравнения материального баланса можно записать так:
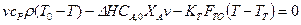 (13.22)
(13.22)
Преобразуем уравнение (13.22) к виду ХА = ХА(Т), чтобы сделать возможным графическое решение системы уравнений материального и теплового балансов (рис. 13.6)
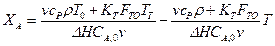 (13.23)
(13.23)
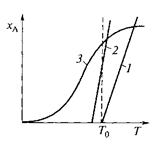
Рис. 13.6. Уравнения материального и теплового балансов для неадиабатического реактора идеального смешения при проведении необратимой экзотермической реакции (совместное решение):
линии уравнения теплового баланса:
1 – адиабатического реактора; 2 – реактора с отводом теплоты; штриховая линия – изотермический реактор;
3 – линия уравнения материального баланса
Уравнение (13.23) – уравнение прямой, как и уравнение теплового баланса (13.15) для адиабатического реактора идеального смешения, но с большим значением свободного члена и большим угловым коэффициентом. Поэтому прямая, описываемая им, смещена относительно линии уравнения теплового баланса адиабатического реактора и имеет большую крутизну (линия 2).
Аналогичные рассуждения можно провести и для реакторов с подводом теплоты для проведения эндотермических реакций.
Предельным случаем неадиабатического реактора является изотермический аппарат, в котором вся теплота реакции компенсируется теплообменом с внешней средой. Уравнение теплового баланса для изотермического реактора изобразится прямой линией, параллельной оси ординат (Т = Т0) – на рис. 13.6 штриховая линия.
 2015-04-17
2015-04-17 3037
3037
