Теория атома водорода по Бору. Момент импульса электрона (первый постулат Бора)
Ln = ћn, или munrn = ћn,
где m – масса электрона; un – скорость электрона на n -й орбите; rn – радиус n -й стационарной орбиты; ћ – постоянная Планка; n – главное квантовое число (n = 1, 2, 3,...).
Энергия электрона в водородоподобном атоме
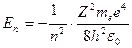 (n = 1, 2, 3…).
(n = 1, 2, 3…).
Энергия, излучаемая или поглощаемая атомом водорода (второй постулат Бора),
ε = ћw = En1-En2,
или
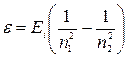 ,
,
где n1 и n2 – квантовые числа, соответствующие энергетическим уровням, между которыми совершается переход электрона в атоме, Ei –энергия ионизации.
Обобщенная формула Бальмера
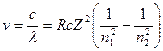 ,
,
где ν частота или λ длина волны, соответствующие линиям спектра водородоподобных ионов излучения или поглощения атомом; R – постоянная Ридберга, Z – порядковый номер элемента.
Волновые свойства частиц. Длина волны де Бройля
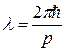 ,
,
где р – импульс частицы.
Импульс частицы и его связь с кинетической энергией Т:
а) 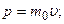
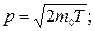
б) 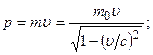
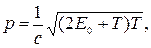
где m0 – масса покоя частицы; m – релятивистская масса; u – скорость частицы; с – скорость света в вакууме; Е0 – энергия покоя частицы (Е0 = m0с2).
Соотношение неопределенностей:
а) ΔpxΔx ³ ћ (для координаты и импульса),
где Δрx – неопределенность проекции импульса на ось X; Δх – неопределенность координаты;
б) ΔEΔ t ³ ћ (для энергии и времени),
где ΔE – неопределенность энергии; Δt – время жизни квантовой системы в данном энергетическом состоянии.
Одномерное уравнение Шредингера для стационарных состояний
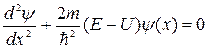 ,
,
где y (x) – волновая функция, описывающая состояние частицы; m –
масса частицы; Е – полная энергия; U = U (x) – потенциальная энергия частицы.
Плотность вероятности
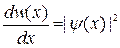 ,
,
где dw (x) – вероятность того, что частица может быть обнаружена вблизи точки с координатой х на участке dx.
Вероятность обнаружения частицы в интервале от х1 до х2
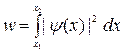 .
.
Решение уравнения Шредингера для одномерного, бесконечно глубокого, прямоугольного потенциального ящика:
а) 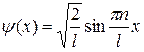 (собственная нормированная волновая функция);
(собственная нормированная волновая функция);
б) 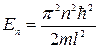 (собственное значение энергии),
(собственное значение энергии),
где n – квантовое число (n = 1, 2, 3,...); l – ширина ящика. В области 0£ x £ l U = µ и y (x) = 0.
Атомное ядро. Радиоактивность. Массовое число ядра (число нуклонов в ядре)
A = Z+N,
где Z – зарядовое число (число протонов); N – число нейтронов.
d N = λN d t, или N = N0 e -λt,
где d N – число ядер, распадающихся за интервал времени d t; N – число ядер, не распавшихся к моменту времени t; N0 – число ядер в начальный момент (t = 0); λ – постоянная радиоактивного распада.
Число ядер, распавшихся за время t,
ΔN = N0-N = N0 (1 - e -λt).
В случае, если интервал времени Δt, за который определяется число распавшихся ядер, много меньше периода полураспада Т1 /2, то число распавшихся ядер можно определить по формуле
ΔN = λNΔt.
Зависимость периода полураспада от постоянной радиоактивного распада
T1 /2 = (ln2)/ λ = 0,693/ λ.
Среднее время τ жизни радиоактивного ядра, т.е. интервал времени, за который число нераспавшихся ядер уменьшается в е раз,
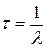 .
.
Число N атомов, содержащихся в радиоактивном изотопе,
N = mNA/M,
где m – масса изотопа; М – молярная масса; NA – постоянная Авогадро.
Активность А радиоактивного изотопа
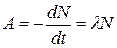 , или
, или 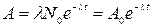 ,
,
где d N – число ядер, распадающихся за интервал времени d t; A0 – активность изотопа в начальный момент времени
Удельная активность изотопа
a = A/m.
Дефект массы ядра
Δm = Zmp +(A-Z) mn - mя,
где Z – зарядовое число (число протонов в ядре); А – массовое число (число нуклонов в ядре); (А — Z) – число нейтронов в ядре; mр – масса протона; mn – масса нейтрона; mя – масса ядра.
Энергия связи ядра
Eсв = Δmc2,
где Δm – дефект массы ядра; с – скорость света в вакууме.
Во внесистемных единицах энергия связи ядра равна Eсв = 931 Δm, где дефект массы Δm – в а.е.м.; 931 – коэффициент пропорциональности (1 а.е.м.~931МэВ).
 2015-04-01
2015-04-01 1555
1555








