В зависимости от количества атомов, образующих молекулу, и расположения в пространстве линий связей, существуют молекулы самой разной формы. Рассмотрим некоторые из них.
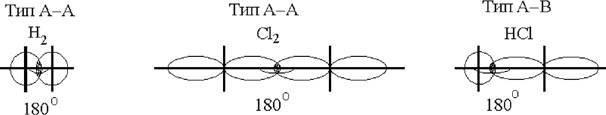
Линейные молекулы. Наиболее простая форма образования связи в двухатомных молекулах АА или АВ, когда оба атома одновалентны (валентный угол – 180°).
В этих случаях электронная плотность симметрично распределена или оттянута к более электроотрицательному атому (рис. 3.5).
|
Рис. 3.5. Схемы образования двухатомных линейных молекул
| н |
| 104 5 |
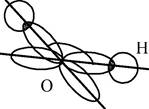 Угловые молекулы. Молекулы типа А2В, например Н2О. У атома кислорода валентными являются 2 неспаренных р-электрона (О 2s22p4). Два р-облака обычно располагаются в пространстве под углом 90°. Но в молекуле воды валентный угол составляет 104°5′ (рис. 3.6). Это объясняется полярностью связи О–Н, т. е. общее электронное облако оттянуто к более электроотрицательному атому кислорода. На атомах водорода появляется положительный заряд и они начинают отталкиваться, увеличивая валентный угол.
Угловые молекулы. Молекулы типа А2В, например Н2О. У атома кислорода валентными являются 2 неспаренных р-электрона (О 2s22p4). Два р-облака обычно располагаются в пространстве под углом 90°. Но в молекуле воды валентный угол составляет 104°5′ (рис. 3.6). Это объясняется полярностью связи О–Н, т. е. общее электронное облако оттянуто к более электроотрицательному атому кислорода. На атомах водорода появляется положительный заряд и они начинают отталкиваться, увеличивая валентный угол.
| Рис. 3.6. Схема образования химической связи в молекуле воды |
Элементы VI группы – аналоги кислорода, также образуют угловые молекулы, но
т. к. связь Н–Э в этом ряду становится менее полярной, то валентный угол у них приближается к 90°:
| Молекула | Валентный угол, град. |
| Н2О | 104,5 |
| Н2S | |
| Н2Se | |
| Н2Те |
 2015-04-01
2015-04-01 341
341








