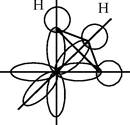
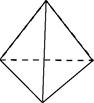
Пирамидальные молекулы. Молекулы типа А3В, например NH3, PH3. Связь в этих молекулах осуществляется тремя неспаренными р-электронными облаками, расположенными под углом 120° по трем координатным осям (рис. 3.7, а).
 |
 |
| Н |
| N |
н
н
N
н
а б
Рис. 3.7. Схема образования химической связи в молекуле аммиака
Форма молекулы – трехгранная пирамида, построенная на треугольном основании. Но и как в случае с молекулой воды, вследствие полярности связи валентный угол отличается от 120° (рис. 3.7, б).
Сложнее происходит образование химической связи у элементов второго периода - бериллия, бора, углерода. Здесь участие в образовании связи принимают и s- и р-электроны. И хотя исходные электронные облака имеют различную форму и энергию, полученные в молекуле связи оказываются равноценными и по длине, и по энергии. Возникает вопрос, каким образом неравноценные по исходному состоянию электроны образуют равноценные химические связи? Ответ на этот вопрос дает теория гибридизации, разработанная Слейтером и Полингом.
 2015-04-01
2015-04-01 1116
1116








