Направленность – это важнейшее свойство связи, определяющее геометрию молекул, их пространственную структуру. Причина направленности ковалентной связи заключается в том, что перекрывание орбиталей, образующих химическую связь, происходит в направлении их наибольшей плотности.
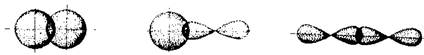
s-s s-p p-p
Рис. 3.3. Схемы перекрывания электронных облаков при образовании σ-связей
7Г
7Г
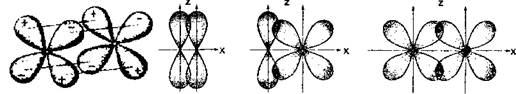
|
d–d
Р-р
p-d
d–d
Рис. 3.4. Схемы перекрывания атомных орбиталей при образовании 5 - и л-связей
Так как форма атомных орбиталей и их плотность разная, то связь имеет разное направление:
s-облака - сферические, образуют связи по всем направлениям;
р-облака - «гантели», располагаются в пространстве по трем координатным осям рх, ру, рz и образуют связи вдоль этих осей.
В зависимости от расположения области перекрывания электронных облаков при образовании химической связи различают три вида направленности ковалентной связи, а именно а-, л - и 8-связи.
При G-связи область перекрывания электронных облаков лежит вдоль линии, связывающей центры взаимодействующих атомов. Это самая прочная и самая распространенная связь. Там, где имеется ординарная связь, это всегда а-связь (рис. 3.3).
При п-связи область перекрывания электронных облаков лежит в плоскости, перпендикулярной линии, соединяющей центры взаимодействующих атомов и есть две области перекрывания. Эта связь длиннее а-связи и менее прочная (рис. 3.4).
Для d-электронных облаков характерна Ъ-связь (рис. 3.4), которая образуется при перекрывании облаков перпендикулярно плоскости расположения их в пространстве, т. е. перекрываются все четыре лепестка d-облаков. 8-связь осуществляется при кратности связи больше трех. Это очень слабая ковалентная связь.
 2015-04-01
2015-04-01 352
352







