Пример 1. Триметилгидропероксид 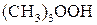 реагирует с двухвалентным железом по реакции:
реагирует с двухвалентным железом по реакции:
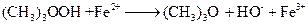 .
.
Реакция протекает в водном растворе при рН =1. Константа скорости этой реакции при Т =298 К равна 16,4 л/(моль×с), опытная энергия активации 38,6 кДж/моль. Плотность гидропероксида 1,226 г/см3, M = 84 г/моль, плотность раствора, содержащего Fe2+, равна 1,2135, М= 56 г/моль. Рассчитать долю активных столкновений из общего числа столкновений, константу скорости данной реакции по теории активных столкновений при Т =298 К и оцените стерический множитель Р.
Р е ш е н и е.
1. Эффективный диаметр столкновений рассчитаем по плотности гидропероксида и раствора железа (+2):
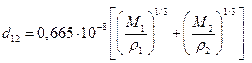 =
= 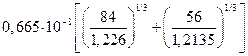 =
=
=5,099∙10-8 см. Откуда: 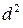 = 2,6·10-15см2.
= 2,6·10-15см2.
2. Опытная энергия активации связана с теоретической соотношением:
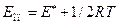 . Откуда
. Откуда 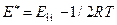 = 38600 -0,5×8,314∙298= 37361,214 Дж/моль
= 38600 -0,5×8,314∙298= 37361,214 Дж/моль
3. Доля активных столкновений из общего числа столкновений молекул равна:
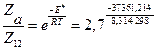 = 3,13∙10-7.
= 3,13∙10-7.
4. Константу скорости по теории активных столкновений рассчитаем по формуле для случая столкновения двух разных молекул:
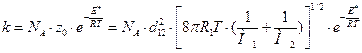 [2] см3/(моль·с).
[2] см3/(моль·с).
k = 6,022·1023·2,6·10-15 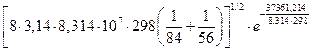 =
=
6,67 ×106 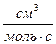 =6,67 ×103
=6,67 ×103 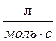 .
.
5. Стерический множитель Р рассчитаем по формуле: 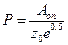 , где А оп – значение предэкспоненциального множителя в уравнении зависимости константы скорости от температуры
, где А оп – значение предэкспоненциального множителя в уравнении зависимости константы скорости от температуры 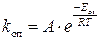 .
.
Значение предэкспоненциального множителя равно: 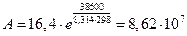 л/(моль×с).
л/(моль×с).
Частота стокновений равна: 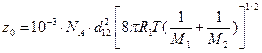 =
=
=10-3·6,022·1023·2,6·10-15 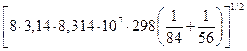 = 2,046×1010 л/(моль×с).
= 2,046×1010 л/(моль×с).
Стерический множитель Р равен:
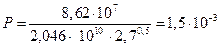 .
.
Вывод: Реакция взаимодействия триметилгидропероксида с двухвалентным железом относится к бимолекулярным реакциям с валентно-насыщенными молекулами, для которых характерно высокое значение энергии активации и малое значение стерического множителя Р.
 2015-04-01
2015-04-01 1933
1933
