Теория активированного комплекса или переходного состояния основана на том, что элементарный акт взаимодействия молекул состоит в постепенной перестройке химических связей, при котором начальная конфигурация атомов в исходных молекулах переходит в конечную у продуктов реакции при непрерывном изменении межатомных расстояний.
Количественную теорию, основанную на этих представлениях, с использованием математического аппарата статистической термодинамики, так называемую теорию абсолютных скоростей реакций, предложили Г.Эйринг и М. Поляни и (1935).
Рассмотрим механизм реакцию
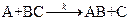 .
.
Согласно теории активированного комплекса при сближении атома А с молекулой ВС ослабляется связь В—С и возникает связь А—В. Процесс завершается образованием молекулы АВ и атома С, для чего система должна пройти через активированный комплекс АВС 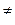 , когда атом В в одинаковой степени принадлежит молекулам ВС и АВ:
, когда атом В в одинаковой степени принадлежит молекулам ВС и АВ:
Качественные представления об элементарном акте как о сложном процессе перестройки химических связей при сближении молекул, а также представления о поверхности потенциальной энергии и координате реакции называют теорией активированного комплекса или переходного состояния.
Строгая количественная теория, основанная на этой физической модели механизма элементарного акта, должна состоять в теоретическом расчете энергетической поверхности реакции методами квантовой механики и в теоретической оценке на этой основе энергии активации и предэкспоненциального множителя. Сделать это пока не удается, из-за математических трудностей. Поэтому пользуются приближенной математической моделью, так называемой теорией абсолютных скоростей реакций.
Согласно этой теории, скорость любой химической реакции равна скорости перехода активированного комплекса через потенциальный барьер, т.е. скорости распада активированного комплекса в продукты реакции. При этом молекула активированного комплекса проходит путь d (рис. 8).
При выводе выражения для константы скорости в теории активированного комплекса элементарную реакцию рассматривают как одномерное поступательное движение по координате реакции в направлении продуктов реакции. При этом сделаны следующие длпущения:
1. В ходе химической реакции на вершине потенциального барьера образуется активированный комплекс (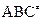 ), состоящий из молекул исходного вещества и продуктов реакции.
), состоящий из молекул исходного вещества и продуктов реакции.
2. Активированный комплекс на участке 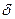 (рис.8) совершает одномерное поступательное движение в направлении продуктов реакции.
(рис.8) совершает одномерное поступательное движение в направлении продуктов реакции.
3. Движение по пути реакции может быть описано в терминах классической механики без учета квантовых эффектов.
4. Элементарная реакция происходит адиабатически, то есть без перехода на другую поверхность потенциальной энергии.
Таким образом, активированный комплекс рассматривается как обычная молекула, у которой одна колебательная степень свободы заменена на поступательную в направлении продуктов реакции.
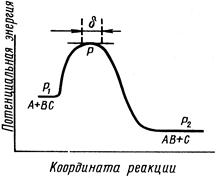 Рис. 8. Путь процесса на основе модели актвированного комплекса. d – область существования активированного комплекса Рис. 8. Путь процесса на основе модели актвированного комплекса. d – область существования активированного комплекса |
Процесс перехода активированного комплекса в продукты реакции – реакция первого порядка.
Основным уравнением теории абсолютных скоростей реакции (без вывода) является уравнение, связывающее константу скорости реакции со свойствами переходного состояния через суммы по состояниям:
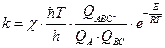 , (4.216)
, (4.216)
где 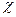 - это добавочный множитель, называемый трансмиссионным коэффициентом. Он учитывает долю активных комплексов, которые скатываются с вершины потенциального барьера в долину продуктов реакции. Для большинства реакций трансмиссионный коэффициент близок к единице;
- это добавочный множитель, называемый трансмиссионным коэффициентом. Он учитывает долю активных комплексов, которые скатываются с вершины потенциального барьера в долину продуктов реакции. Для большинства реакций трансмиссионный коэффициент близок к единице;
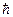 = 1,381∙10-23 Дж/К – постоянная Больцмана; T – температура, К;
= 1,381∙10-23 Дж/К – постоянная Больцмана; T – температура, К;
h =6,626∙10-34 Дж×с – постоянная Планка; 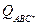 – сумма по состояниям активированного комплекса;
– сумма по состояниям активированного комплекса; 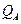 и
и 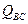 – суммы по состояниям исходных веществ;
– суммы по состояниям исходных веществ; 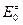 - энергия активации; множитель
- энергия активации; множитель 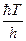 , имеет размерность частоты (сек-1).
, имеет размерность частоты (сек-1).
Предполагается, что химическая реакция протекает без нарушения равновесного распределения молекул реагентов по энергиям, а между реагентами и активированным комплексом существует динамическое равновесие, поэтому концентрацию активированных комплексов можно выразить через термодинамическую константу равновесия.
Если ввести обозначение:
 , (4.217)
, (4.217)
то наиболее общее уравнение теории абсолютных скоростей реакции можно записать:
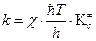 , (4.218)
, (4.218)
где 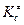 –константа равновесия образования активированного комплекса, выраженная через молярные концентрации (моль/л).
–константа равновесия образования активированного комплекса, выраженная через молярные концентрации (моль/л).
В зависимости от того, как рассчитывают константу равновесия, различают статистический(4.217) и термодинамический (4.218) аспекты теории активированного комплекса.
 2015-04-01
2015-04-01 14926
14926








