Установлено, что гидролиз очень разбавленного раствора эфира при 25 °С протекает по кислотно-основному механизму катализа, при этом обратная реакция (этерификации) практически не происходит, эфир растворим в воде и в отсутствие катализатора константа скорости реакции практически равна нулю. Процесс протекает по следующей схеме.
В случае основного катализа:
эфир + ОН– 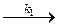 (эфирОН)– (1)
(эфирОН)– (1)
(эфирОН)– +Н2О 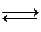 кислота + спирт + ОН– . – быстрая стадия
кислота + спирт + ОН– . – быстрая стадия
В случае кислотного катализа:
эфир + Н+ 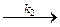 (эфир Н)+ (2)
(эфир Н)+ (2)
(эфир Н)+ + Н2О 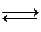 кислота + спирт + Н+ . – быстрая стадия
кислота + спирт + Н+ . – быстрая стадия
Экспериментально показано, что скорость гидролиза эфира практически одинакова для значений р Н =1 и р Н=9.
Проведите следующие исследования:
а) получите выражение для опытной константы скорости реакции и ответьте на вопрос, зависит ли эта константа от р Н раствора;
б) определите, чему равна р Н при минимальном значении константы скорости реакции. Какой катализ (ионами Н+ или ОН–) более эффективен в этом случае?
Решение.
а) На основании предложенной схемы лимитирующими стадиями процесса гидролиза являются реакции (1) и (2), поэтому выражение для скорости реакции имеет вид:
v 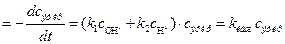 , (3)
, (3)
Откуда кажущаяся константа скорости гидролиза эфира равна:
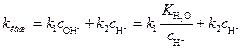 (4)
(4)
где 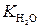 – константа диссоциации воды. При 298 К
– константа диссоциации воды. При 298 К 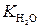 = 10–14.
= 10–14.
Соотношение (4) показывает, что кажущаяся константа скорости реакции 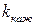 зависит от р Н раствора, причем
зависит от р Н раствора, причем 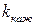 k должна проходить через минимум при условии
k должна проходить через минимум при условии 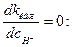
или
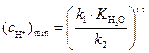 (5)
(5)
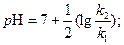 (6)
(6)
б) используя опытные данные, а именно то, что скорость гидролиза эфира практически одинакова для значений р Н =1 и р Н=9, можно из формулы (4) получить отношение констант 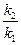 :
:
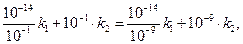 (7)
(7)
откуда
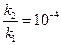 или
или 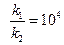 (8)
(8)
Подставляя численное значение отношения 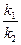 в выражении (6),
в выражении (6),
легко вычисляем значение р Н раствора в точке минимума кажущейся константы скорости
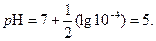 (9)
(9)
Полученный результат объясняет, почему эфиры хранят, например, в парфюмерии при р Н = 5.
 2015-04-01
2015-04-01 938
938








