| Основные гидроксиды (основания) | ||||
– основный гидроксид + кислота = соль + Н2О Fе(ОН)2 + 2НС1 = FеС12 + 2Н2О; – основный гидроксид + кислотный оксид = соль + Н2О Са(ОН)2 + SO3 = CaSO4 + Н2О; – основный гидроксид + соль = другой основный гидроксид + другая соль 2 NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4; – основный гидроксид + основный оксид ≠ NaOH + CuO ≠; – основный гидроксид + основный гидроксид ≠ Са(ОН)2 + NaOH ≠; – нерастворимые в воде гидроксиды разлагаются при нагревании Сu(ОН)2 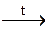 СuО + Н2О. СuО + Н2О. | ||||
| Амфотерные гидроксиды | ||||
| Многие малорастворимые в воде гидроксиды проявляют двойственный химический характер, т.е. в кислой среде реагируют как основания, а в щелочной–как кислоты. Объясняют это тем, что эти молекулы способны диссоциировать по двум типам–по типу кислоты и по типу основания. | ||||
| К амфотерным гидроксидам относятся: Zn(ОН)2; Ве(ОН)2; Аl(ОН)3; Сr(ОН)3, Fe(OH)3, Pb(OH)2, Mn(OH)4, V(OH)3, Sn(OH)2. | ||||
Молекулы Zn(ОН)2 способны диссоциировать и как основание, и как кислота.
H+ + HZnO2- (по типу кислоты) – амфотерный гидроксид + кислота = соль + вода Zn(OH)2 + 2НСl = ZnСl2 + 2Н2О; Zn(OH)2 + 2Н+ = Zn2+ + 2Н2О; – амфотерный гидроксид + щелочь = комплексная соль Zn(OН)2 + 2NaОН- = Na2[Zn(OH)4]; Zn(OН)2 + 2ОН- = [Zn(OH)4]2-; или амфотерный гидроксид + щелочь = соль + вода Zn(OН)2 + 2NaOH = Na2ZnO2 + 2H2O; Zn(OН)2 + 2ОН-= ZnO22- + 2H2O. |
Химические свойства гидроксидов
|
|

Сейчас читают про:
 2015-04-01
2015-04-01 1621
1621









