несолеобразующие N2O; NO.
| Оксид азота (II) NO– бесцветный газ, плохо растворимый в воде.
Свойства:2NO+O2=2NO2 (О2 из воздуха).
Получение:
2Cu+HNO3(р)=2Cu(NO3)2+2NO↑+4H2O – в лаборатории;
4NH3+5O2=4NO+6H2O (кат. Pt) – в промышленности.
|
Оксид азота (IV) NO2 – газ бурого цвета со специфическим запахом, тяжелее воздуха, ядовит.
Свойства:
1) 2NO2+H2O=HNO2+HNO3; 4NO2+2H2O+O2(изб.)=4HNO3;
2) 2NO2+2NaOH=NaNO3+NaNO2+H2O;
3) димеризация 2NO2 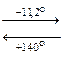 N2O4.
Получение: Cu+4HNO3(конц.)=Cu(NO3)2+2NO2↑+2H2O. N2O4.
Получение: Cu+4HNO3(конц.)=Cu(NO3)2+2NO2↑+2H2O.
|
| Азотная кислота HNO3
|
| Получение:
В лаборатории: KNO3+H2SO4(конц.)=HNO3+KHSO4 (слабое нагревание)
В промышленности:
4NH3 + 5O2 = 4NO + 6H2O (Кат. – Pt);
2NO + O2 = 2NO2;
4NO2 + 2H2O + O2 = 4HNO3.
|
| Физические свойства:
Бесцветная жидкость с едким запахом. Смешивается с водой. Т кипения = 86˚С.
|
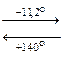 N2O4.
Получение: Cu+4HNO3(конц.)=Cu(NO3)2+2NO2↑+2H2O.
N2O4.
Получение: Cu+4HNO3(конц.)=Cu(NO3)2+2NO2↑+2H2O.
 2015-04-01
2015-04-01 430
430








