Общая характеристика
  N
P
As
Sb N
P
As
Sb
 Bi Bi
s p Степень окисления ns2np3 – последний уровень |
АЗОТ N
| В природе:в воздухе в свободном состоянии; в почве в виде соединений; в белковых веществах и органических соединениях. |
| Получение: 1) В промышленности: воздух переводят в жидкое состояние, далее испарением отделяют азот от кислорода. 2) В лаборатории – термическим разложением нитрита аммония: NH4NO2 = N2↑ + 2H2O. |
| Физические свойства:N2 – газ без цвета, запаха и вкуса, чуть легче воздуха, мало растворим в воде. Ткипения = 196˚С |
Химические свойства
Степени окисления: +1, +2, +3, +4, +5, –1, –2, –3
 N≡N – молекула азота, прочная связь, низкая реакционная способность.
N2 + 6Li = 2Li3N (при комн. t)
N2 + 3Ca = Ca3N2 (при высок. t) N – окислитель
N2 +3H2 = 2NH3 (t высок., Р, Кат.)
N2 + O2 = 2NO (t = 3000–4000˚C) N – восстановитель N≡N – молекула азота, прочная связь, низкая реакционная способность.
N2 + 6Li = 2Li3N (при комн. t)
N2 + 3Ca = Ca3N2 (при высок. t) N – окислитель
N2 +3H2 = 2NH3 (t высок., Р, Кат.)
N2 + O2 = 2NO (t = 3000–4000˚C) N – восстановитель
|
| Применение: для получения аммиака; для создания инертной среды; для азотирования поверхности стальных изделий с целью увеличения прочности стали; для производства минеральных удобрений. Азот имеет важное значение в жизни растений и животных. |
|
|
|
 2015-04-01
2015-04-01 542
542

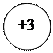


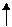
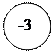 - 3ē
- 3ē
 - 5ē
- 5ē 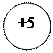 d +3 ē
d +3 ē






