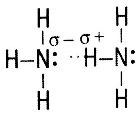
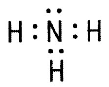
 Аммиак NH3 Аммиак NH3
| Физические свойства: бесцветный газ с характерным резким запахом, в 2 раза легче воздуха. Хорошо растворим в воде – нашатырный спирт. Т кипения = –33,4˚С. Легко сжимается. |
| Химические свойства NH3 | |
| NH3 – основание | NH3 - восстановитель |
1) с кислотами образует соли
NH3+HCl=NH4Cl(хлорид аммония)
2) растворение в воде
NH3+H2О 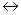 NH3·H2О NH3·H2О 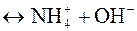
| 1) 3Br2 + 8NH3 = N2↑ + NH4Br
2) 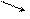 O2 +NH3→N2↑+H2О(горение)
NO+H2О(кат.Pt)
3) 3CuO+2NH3=3Cu+N2↑+3H2О O2 +NH3→N2↑+H2О(горение)
NO+H2О(кат.Pt)
3) 3CuO+2NH3=3Cu+N2↑+3H2О
|
Получение NH3:
1) В промышленности: N2 + 3H2 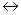 2NH3 (Кат. – губчатое железо + активатор (Al2O3 или CuO))
2) В лаборатории: 2NH4Cl + Ca(OH)2 = CаCl2 + 2NH3↑ + 2H2О (нагревание) 2NH3 (Кат. – губчатое железо + активатор (Al2O3 или CuO))
2) В лаборатории: 2NH4Cl + Ca(OH)2 = CаCl2 + 2NH3↑ + 2H2О (нагревание)
| |
| Применение:для получения азотной кислоты,солей, мочевины, соды, минеральных удобрений. |
Качественные реакции на ионы аммония:
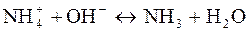 (со щелочами)
определяют по запаху аммиака или изменению цвета лакмуса (с красного на синий) (со щелочами)
определяют по запаху аммиака или изменению цвета лакмуса (с красного на синий)
|
 2015-04-01
2015-04-01 537
537








