Большую роль в металлургических процессах играет реакция взаимодействия твердого углерода с кислородсодержащей газовой фазой. Взаимодействие кислорода газовой фазы с твердым углеродом происходит по двум реакциям:
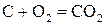 ;(1)
;(1)
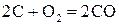 .(2)
.(2)
При избытке твердого углерода в системе реакции (1) и (2) характеризуются очень низким остаточным содержанием кислорода в равновесной газовой смеси. Соотношение между 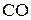 и
и 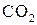 в равновесной газовой смеси можно установить из анализа условий равновесия реакции газификации твердого углерода:
в равновесной газовой смеси можно установить из анализа условий равновесия реакции газификации твердого углерода:
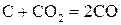 ;(3)
;(3)
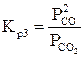 . (4)
. (4)
Для расчета равновесного состава газовой фазы реакции (3) записываем константу равновесия (4) через состав смеси, выраженный в объемных процентах:
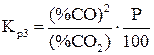 , (5)
, (5)
где Р – общее давление в газовой смеси.
Если в газовой фазе нет других газов, кроме 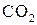 и
и 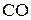 , то их сумма равна 100%. Обозначим: (
, то их сумма равна 100%. Обозначим: (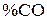 ) = х; (
) = х; (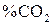 ) = 100–х.
) = 100–х.
Подставляя эти обозначения в выражение для константы равновесия, получаем:
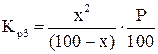 .
.
Решение полученного квадратного уравнения позволяет определить равновесную концентрацию окиси углерода в газовой смеси:
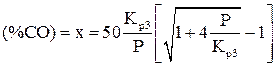 . (6)
. (6)
Взаимодействие газовой смеси из кислорода и азота (обычный или обогащенный кислородом воздух) с твердым углеродом приводит при избытке твердого углерода в системе к образованию смеси из 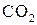 и
и 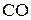 с определенным содержанием в ней азота. Для определения равновесного состава газовой фазы реакции (3) в этом случае вводим обозначения: (
с определенным содержанием в ней азота. Для определения равновесного состава газовой фазы реакции (3) в этом случае вводим обозначения: (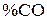 ) = х; (
) = х; (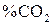 ) = y; (
) = y; (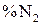 ) = z.
) = z.
Составляем уравнения, связывающие переменные величины x, y и z:
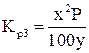 ; (7) x + y + z = 100. (8)
; (7) x + y + z = 100. (8)
Третье уравнение определяет содержание азота в смеси. На образование 1 моля 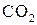 расходуется 1 моль
расходуется 1 моль 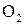 , а на образование 1 моля
, а на образование 1 моля 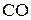 – 0,5 моля
– 0,5 моля 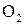 . Для обогащенного кислородом воздуха вводим обозначение
. Для обогащенного кислородом воздуха вводим обозначение
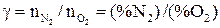 ,
,
т.е. каждый моль 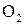 вносит в смесь γ молей
вносит в смесь γ молей 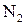 . Поэтому третье уравнение имеет вид:
. Поэтому третье уравнение имеет вид: 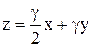 . (9)
. (9)
Решая систему уравнений (7)–(9), находим значение х, т.е. содержание 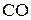 в равновесной газовой смеси:
в равновесной газовой смеси:
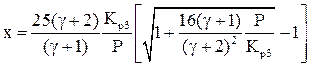 . (10)
. (10)
Далее из уравнения (7) находим величину у, а из уравнения (8) – величину z.
Для нахождения относительного содержания 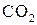 и
и 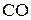 в составе смеси пользуемся соотношением
в составе смеси пользуемся соотношением
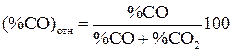 ; (11)
; (11)
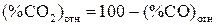 . (12)
. (12)
Значение равновесного давления кислорода в газовой смеси находим из условий равновесия реакции 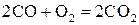 для заданной температуры и давления.
для заданной температуры и давления.
Константа равновесия этой реакции
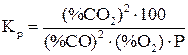 . (13)
. (13)
Равновесное давление кислорода в газовой смеси
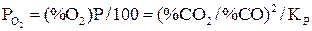 . (13)
. (13)
Значение кислородного потенциала для равновесной газовой смеси 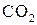 –
– 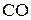 в присутствии твердого углерода определяем по уравнению
в присутствии твердого углерода определяем по уравнению
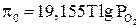 . (14)
. (14)
Пример 1. Определить состав равновесной газовой смеси, полученной при взаимодействии обогащенного кислородом воздуха с твердым углеродом для заданных условий и рассчитать равновесное давление кислорода в газовой смеси.
Условия задачи:
· состав обогащенного воздуха: 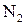 – 76%,
– 76%, 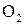 – 24%;
– 24%;
· общее давление в системе Р’= 0,5·105 Па;
· расчет произвести для шести температур в интервале 700…950 °С.
Решение. Исходные данные для расчета приводим в виде табл. 1.
Таблица 1
| Состав обогащенного воздуха, % | Температура, °С | Давление Р’, Па | ||||||
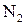 | 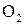 | |||||||
| 0,5·105 |
Для определения равновесного состава газовой смеси находим соотношение между азотом и кислородом в обогащенном воздухе:
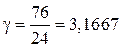 .
.
Пользуясь уравнением 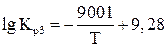 , находим значения
, находим значения 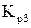 для шести заданных температур (табл. 2).
для шести заданных температур (табл. 2).
Таблица 2
| Т, К | ||||||
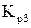 | 1,07 | 3,03 | 7,79 | 18,40 | 40,41 | 83,22 |
Подставляя величины Р=Р’· 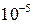 и
и 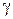 в уравнение (10), получаем расчетное уравнение для определения значений х при заданных температурах:
в уравнение (10), получаем расчетное уравнение для определения значений х при заданных температурах:
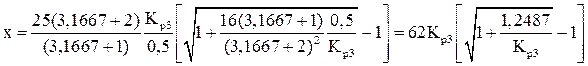 .
.
Подставляя в полученное уравнение найденные ранее значения 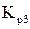 , находим значения х для шести заданных температур.
, находим значения х для шести заданных температур.
Подставляя значение Р=Р’·  в уравнение (7), получаем расчетное уравнение для определения величин y при заданных температурах:
в уравнение (7), получаем расчетное уравнение для определения величин y при заданных температурах:
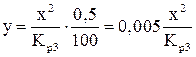 .
.
Находим значения y для найденных величин х. Подставляя полученные значения хи y в уравнение (8), находим
z = 100 – (x + y).
По уравнениям (11) и (12) определим относительное содержание 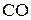 и
и 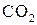 в составе смеси для заданных температур.
в составе смеси для заданных температур.
Определение равновесного давления кислорода в газовой смеси 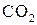 –
– 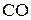 производим путем подстановки в уравнение (14) значений концентраций
производим путем подстановки в уравнение (14) значений концентраций 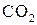 и
и 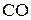 для соответствующих температур:
для соответствующих температур:
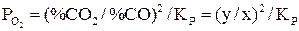 .
.
Расчет значений 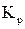 производим по уравнению
производим по уравнению
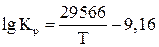 .
.
Результаты расчета сводим в табл. 3 (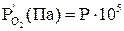 ) [5].
) [5].
Таблица 3
| № п/п | T, °C | T, К | Состав равновесной газовой смеси, % | Относительное содержание, % | 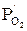 , Па , Па | 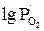 | |||
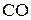 | 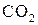 | 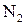 | 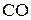 | 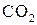 | |||||
| 31,32 | 4,58 | 64,10 | 87,2 | 12,8 | 1,28· 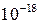 | –17,89 | |||
| 35,39 | 2,78 | 62,54 | 94,5 | 5,5 | 6,19· 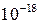 | –17,21 | |||
| 37,27 | 0,89 | 61,84 | 97,7 | 2,3 | 2,31· 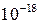 | –16,69 | |||
| 38,07 | 0,39 | 61,54 | 99,0 | 1,0 | 7,27· 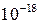 | –16,14 | |||
| 38,42 | 0,18 | 61,40 | 99,5 | 0,5 | 2,02· 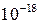 | –15,69 | |||
| 38,56 | 0,09 | 61,35 | 99,8 | 0,2 | 5,25· 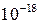 | –15,28 |
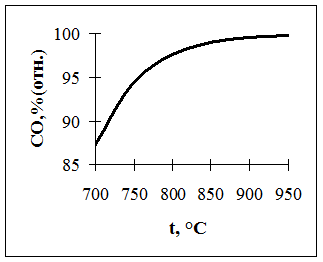
Используя расчетные данные, строим графики зависимости состава равновесной газовой смеси для реакции газификации углерода от температуры (рис. 1) и зависимости равновесного давления кислорода в газовой смеси (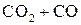 ) для реакции газификации углерода от температуры (рис. 2).
) для реакции газификации углерода от температуры (рис. 2).
 Ошибка! Раздел не указан.
Ошибка! Раздел не указан.
Рис. 1. Зависимость относительного содержания 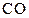 в газовой смеси для реакции газификации углерод от температуры
в газовой смеси для реакции газификации углерод от температуры
Рис. 2. Зависимость равновесного давления кислорода в газовой смеси 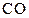 –
–  для реакции газификации углерода от температуры
для реакции газификации углерода от температуры
Задание. Для заданного варианта условий задачи (табл. 4) рассчитать значения равновесного давления кислорода и кислородных потенциалов в равновесной газовой смеси, образующейся при взаимодействии обогащенного кислородом воздуха (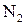 –
– 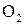 ) с твердым углеродом для шести заданных температур.
) с твердым углеродом для шести заданных температур.
Результаты расчета привести в виде табл. 4.
Таблица 4
Результаты расчета окислительных свойств газовой смеси
| № п/п | t, °C | T, K | Состав равновесной газовой смеси, % | Относительное содержание, % | 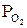 , Па , Па | 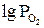 | 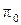 , Дж , Дж | |||
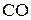 | 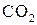 | 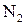 | 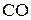 | 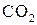 | ||||||
Варианты условий задачи приведены в табл. 5.
Таблица 5
| № вари-анта | Состав обогащенного воздуха, % | Температура, °C | Давление, Па·10-5 | ||||||
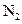 | 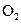 | ||||||||
| 0,5 | |||||||||
| 0,5 | |||||||||
| 0,5 | |||||||||
| 0,5 | |||||||||
| 0,5 | |||||||||
| 0,9 | |||||||||
| 0,9 | |||||||||
| 0,9 | |||||||||
| 0,9 | |||||||||
| 0,9 | |||||||||
| 0,9 | |||||||||
| 1,3 | |||||||||
| 1,3 | |||||||||
| 1,3 | |||||||||
| 1,3 | |||||||||
| 1,3 | |||||||||
| 1,3 | |||||||||
| 1,7 | |||||||||
| 1,7 | |||||||||
| 1,7 | |||||||||
| 1,7 | |||||||||
| 1,7 | |||||||||
| 1,7 | |||||||||
| 2,1 | |||||||||
| 2,1 | |||||||||
| 2,1 | |||||||||
| 2,1 | |||||||||
| 2,1 | |||||||||
| 2,1 |
Контрольные вопросы
1. Понятие кислородного потенциала сложной газовой фазы.
2. Общие характеристики окислительного потенциала газовой фазы.
3. Расчет равновесного давления кислорода и кислородных потенциалов в равновесной газовой смеси.
4. Факторы, влияющие на изменение равновесного состава газовой фазы при окислении твердого углерода.
 2015-04-01
2015-04-01 2077
2077