Физические величины, характеризующие состояние ТД системы называются ТД параметрами. Основными параметрами являются температура, давление и удельный объём. К ним относятся также внутренняя энергия, энтропия, энтальпия и др.
Термодинамические параметры, значения которых не зависят от размеров и массы системы, называют интенсивными параметрами. Это давление, температура, удельный и мольный объём, удельная и мольная внутренняя энергия, удельная и мольная энтальпия, удельная и мольная энтропия и др.
Термодинамические параметры, пропорциональные количеству вещества или массе данной системы, называются экстенсивными. К ним относится масса, объём, внутренняя энергия, энтропия, энтальпия и другие.
Тела, составляющие термодинамические системы, могут пребывать в одном из трёх состояний: жидком, твёрдом или газообразном. При разных условиях состояние одного и того же тела может быть различным. Однако, в одних и тех же условиях рассматриваемое тело всегда будет находиться в одном и том же состоянии. Например, при атмосферном давлении и температуре 500°С вода будет находиться только в виде пара, но не в виде жидкости или твёрдого вещества. Для определения физических условий, при которых рассматривается тело, и для однозначного определения его состояния вводят характеристики состояния - параметры состояния.
Объём – геометрические размеры тела. Т.к. газ стремится занять весь предоставленный ему объём, то для газа объёмом являются геометрические размеры сосуда, в который он помещён. В международной системе единиц СИ объём измеряется в м3. Производными единицами являются литры, причём 1000 л = 1 м3.
Удельный объём вещества - это объём, занимаемый единицей массы данного вещества. Удельный объём v связан с массой вещества m и его объёмом V соотношением:
v = V / m
Если выразить V в м3 и m в кг, то v выразится в м3/кг.
Величина, обратная удельному объёму, называется плотностью (r). По своему физическому смыслу плотность - это масса одного кубического метра газа.
r = 1 / v = m / V
Единицей плотности в системе СИ служит кг/м3, в системе СГС - г/см3.
Плотность и удельный объём зависят от температуры и давления, то есть от термического состояния вещества.
Количество вещества - это физическая величина, определяемая числом структурных элементов. Единицей количества вещества в Международной системе единиц СИ является моль.
Моль - это количество вещества, содержащего столько же структурных элементов (атомов, молекул, ионов, электронов и т.д.), сколько атомов содержится в 0.012 кг изотопа углерода-12.
Молярный (мольный) объём – объём, занимаемый 1 моль газа. Эта величина определяется отношением объёма вещества к его количеству.
V m = V / n,
где V m -молярный объём, V - объём, n - количество вещества.
Молярный объём выражается в м3/моль.
Молярной массой вещества называется масса 1 моль вещества. Она связана с массой вещества и его количеством соотношением:
m = m / n,
где m - молярная масса, которая выражается в кг/моль.
Давление - физическая величина, численно равная отношению нормальной составляющей силы к площади, на которую действует эта сила.
Т.к. для газа, состоящего из большого количества хаотично движущихся молекул, невозможно определить нормальную составляющую, то часто используют более простое определение давления: давление – это сила, с которой молекулы ударяются о стенку сосуда, в который заключён газ.
Единицей давления в системе СИ является Паскаль (Па) – давление, вызываемое силой 1 Н, равномерно распределённой по поверхности 1м2 (1Па= 1Н/м2). В других системах измерения давление также измеряют в мм ртутного столба, мм водного столба, барах, атмосферах, кг×с/см2 и т.д.
Таблица пересчёта давлений приведена в приложении 1.
Различают атмосферное (барометрическое) давление Ратм, абсолютное Рабс, избыточное (манометрическое) Ризб, разрежение (вакуум) Рвак.
Абсолютным давлением называется давление, отсчитываемое от нуля (абсолютного вакуума).
Атмосферным (барометрическим) называют давление, создаваемое атмосферным воздухом. Оно измеряется барометром.
Избыточным (манометрическим) давлением называется давление сверх атмосферного, т.е. избыточное давление – это разность между абсолютным и барометрическим давлениями:
Ризб = Рабс – Ратм
Избыточное давление измеряется манометром.
Разрежением или вакуумметрическим давлением называется разность между атмосферным давлением и абсолютным давлением среды, где измеряется давление.
Рвак = Ратм - Рабс
Давление разрежения измеряется вакуумметром.
В термодинамических уравнениях всегда используется значение абсолютного давления ввиду того, что оно является параметром, характеризующим состояние системы.
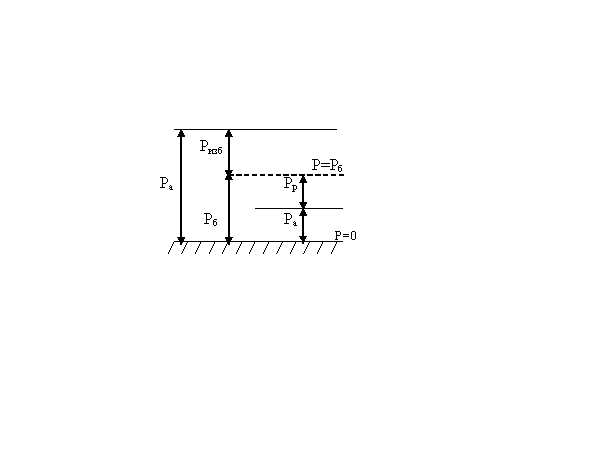
Рис 1. Виды давлений.
Атмосферное давление – величина переменная, поэтому в технике применяется нормальное атмосферное давление, Р0 = 101325 Па (760 мм рт.ст. или 1 атм).
Молекулярно – кинетическая теория газов позволяет установить связь между давлением и кинетической энергией теплового движения молекул газа. Согласно этой теории, рассматривающей идеальный газ, предполагается, что молекулы газа равномерно распределены в объёме и громадное их число находится в хаотичном тепловом движении. Молекулы непрерывно ударяются одна о другую и о стенки сосуда, в котором заключён газ. В результате ударов молекул о стенки создаётся давление, нормальное к поверхности стенок и равномерное во всех направлениях.
Абсолютное давление газа определяется по формуле:
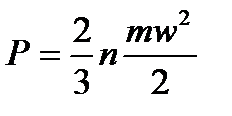 ,
,
где п – число молекул в единице объёма;
т – масса молекулы в однородном газе, для всех молекул принимается одинаковой;
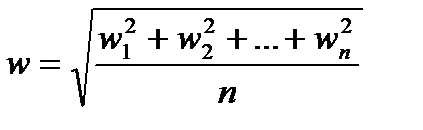 - средняя квадратичная скорость поступательного движения молекул; w1,w2,…,wn – скорости отдельных молекул, образующих газ.
- средняя квадратичная скорость поступательного движения молекул; w1,w2,…,wn – скорости отдельных молекул, образующих газ.
Величина 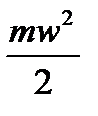 определяет среднюю кинетическую энергию поступательного движения одной молекулы.
определяет среднюю кинетическую энергию поступательного движения одной молекулы.
Температура - мера нагретости тела. Температура определяет направление передачи теплоты. Если два тела А и В имеют соответственно температуру Т1 и Т2 и Т1>Т2, то теплота самопроизвольно переходит от тела А к телу В. При этом температура тела А уменьшается, а температура В – увеличиваются.
Для суждения об одинаковых или различных значениях температур двух тел А и В нет необходимости приводить их в тепловой контакт друг с другом. Можно воспользоваться для этого третьим телом С, приводимым последовательно в контакт с телами А и В. Это тело С носит название термоскопом.
Для количественного определения температуры тела используют температурные шкалы. Проградуированный по какому-либо правилу термоскоп превращается в термометр, т.е. прибор, предназначенный для измерения температур.
Численный отсчёт температуры производится по шкалам температур. В настоящее время применяются различные шкалы: Кельвина, Цельсия, Фаренгейта, Реомюра, Ранкина.
Решением международного комитета мер и весов приняты две шкалы: термодинамическая температурная шкала, которая принята основной, и международная практическая шкала (МПТШ-68), выбранная таким образом, чтобы температура, измеренная по этой шкале была близка к термодинамической (использует шкалу Цельсия).
Наиболее универсальной является абсолютная термодинамическая шкала температур – шкала Кельвина.
Температура по обеим шкалам может быть выражена в Кельвинах и градусах Цельсия. Соотношения между этими температурами следующее:
Т,К = t,°C + 273.15
С точки зрения молекулярно – кинетической теории температура есть мера интенсивности теплового движения молекул. Её численная величина связана с величиной средней кинетической энергией молекул вещества. Для идеального газа эта функциональная зависимость определяется из уравнения:
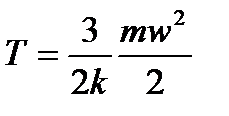 ,
,
где k – постоянная Больцмана (k≈1.3806·10-23 Дж/К).
Температура Т, определённая таким образом, называется абсолютной. Следовательно, в термодинамике рассматривают температуру как среднестатистическую величину которая характеризует систему, состоящую из очень большого числа молекул, находящихся в хаотичном (тепловом) движении. Поэтому к единичным молекулам понятие температуры не приемлемо. Из последнего выражения видно, что значению Т = 0 соответствует w = 0, т.е. при температуре абсолютного нуля тепловое движение молекул отсутствует. Эта предельная минимальная температура называется абсолютным нулём и является началом для отсчёта температур. Понятно, что не может быть Т < 0, т.е. абсолютная температура всегда положительна.
Соотношение между различными шкалами приведены в приложении 2
Абсолютное давление и абсолютная температура связаны между собой соотношением
P = nkT,
где k – постоянная Больцмана, равная 1.3806×10-23 Дж/К,
n - концентрация молекул (количество молекул в единице объёма).
Это уравнение называют основным уравнением кинетической теории газов.
 2015-04-01
2015-04-01 8358
8358
