Пусть в цилиндре под поршнем находится 1 кг газа при давлении Р и температуре Т 1. Если нагревать газ при Р = const до температуры Т2, то объём его v 1 увеличится до v 2. При этом поршень поднимется на высоту h.
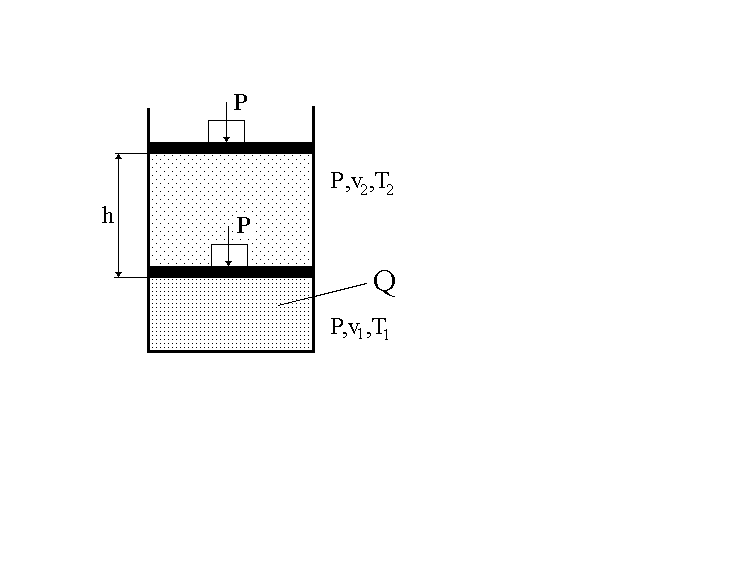
Рис 2. К установлению физического смысла газовой постоянной.
Работа, выполненная газом,
l = Р´ s ´h
где s – площадь поршня.
Произведение s´h равно приращению объёма D v=v 1 + v 2. Поэтому уравнение можно записать в виде
l = P (v 2 - v 1)
Запишем уравнение для двух состояний рабочего тела:
Pv 1 = RT 1
Pv 2 = RT 2
Вычитая из первого уравнения второе, получим
P (v 1 + v 2) = R(T 1- T2)
Отсюда
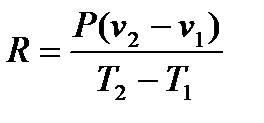
С учётом выражения (l = P (v 1 + v 2)) имеем
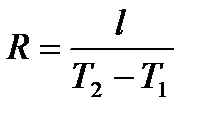
Следовательно, удельная газовая постоянная есть работа, совершаемая 1кг газа в процессе, протекающем при постоянном давлении и изменении температуры на 1 градус.
Газовая постоянная в системе СИ имеет единицы измерения:
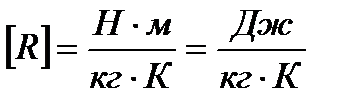
Уравнение Клайперона принимает универсальную форму, если газовую постоянную отнести не к 1 кг, а к 1кмоль газа, что и предложил Д.И. Менделеев.
Умножая обе части уравнения (1) на молярную массу, получим
PV m = R m T
откуда для произвольного количества газа
PV = nR m T,
где n – число киломоль идеального газа.
Это уравнение является наиболее общим для идеальных газов и называется уравнением Клапейрона – Менделеева.
Величина R m называется универсальной газовой постоянной. Универсальная газовая постоянная Rm по физическому смыслу есть работа расширения 1 кмоль идеального газа в процессе, проходящим при постоянном давлении и изменении температуры на 1 градус. (Rm = 8314.2 (Дж/кмоль×К))
Универсальная газовая постоянная и газовая постоянная связаны соотношением:
Rm = mR,
где Rm - универсальная газовая постоянная;
m - молярная масса идеального газа;
R – газовая постоянная идеального газа.
 2015-04-01
2015-04-01 8475
8475
