Под идеальным газом в ТД понимают воображаемый газ, состоящий из упругих молекул, между которыми отсутствуют силы взаимного притяжения и отталкивания, а объём, занимаемый молекулами, бесконечно мал по сравнению с объёмом пространства между ними. Т.о. молекулы идеального газа можно рассматривать как материальные точки, которые не имеют объёма и не взаимодействуют друг с другом. Такой газ полностью подчиняется законам Бойля – Мариотта, Шарля, Гей-Люссака и их обобщённой форме – уравнению Клапейрона.
Эти законы сформулированы в результате экспериментального изучения процессов в газах при небольших давлениях.
Закон Бойля Мариотта устанавливает зависимость между удельным объёмом идеального газа и его давлением при постоянной температуре.
Т = const, PV = const
Для данной массы газа при постоянной температуре произведение давления на объём есть величина постоянная.
Т.е. давление изменяется обратно пропорционально изменению объёма и при этом выполняется соотношение:
P1V1 = P2V2,
где P1 и V1 – начальные параметры газа, P2 и V2 – конечные параметры газа.
Закон Гей-Люссака устанавливает зависимость объёма идеального газа от его температуры при постоянном давлении.
P = const, 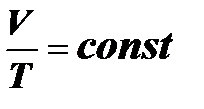
Для данной массы газа при постоянном давлении объём идеального газа изменяется прямо пропорционально изменению абсолютной температуры.
Объём изменяется прямо пропорционально изменению абсолютной температуры.
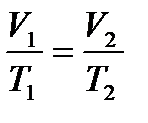
где Т1 и V1 – начальные параметры газа, Т2 и V2 – конечные параметры газа.
Закон Шарля устанавливает зависимость давления идеального газа от его температуры при постоянном объёме.
V = const, 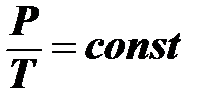
Для данной массы газа при постоянном объёме абсолютное давление изменяется прямо пропорционально изменению его абсолютной температуры.
Давление изменяется прямо пропорционально изменению абсолютной температуры.
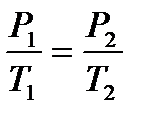
где P1 и Т1 – начальные параметры газа, P2 и Т2 – конечные параметры газа.
Закон Авагадро устанавливает, что при одинаковых физических условиях в различных газах содержится одинаковое число молекул. Экспериментально было найдено, что число Авагодро численно равно 6.022045 · 1023 моль-1.
Из закона Авагодро вытекает важное следствие.
При одинаковых физических условиях произведение удельного объёма газа на его молярную массу есть величина постоянная.
При вычислении мольного объёма идеального газа при нормальных условиях получим, что Vm = 22.414(м3/кмоль)
Объединяя законы Бойля-Мориотта, Гей-Люссака и Шарля получим соотношение, для 1 кг идеального газа:
Pv = RT, (1)
которое называется термическим уравнением состояния идеальных газов. Это уравнение однозначно связывает между собой параметры газа P, v, Т. Уравнение впервые было получено Клапейроном в 1884 г. и названо его именем.
Для произвольного количества идеального газа уравнение состояния имеет вид
PV = mRT,
где Р – абсолютное давление, Па; V – объём газа, м3; m – масса газа, кг; Т – абсолютная температура, К; R - постоянная величина, не зависящая от состояния газа и является индивидуальной для каждого газа. Эту величину, отнесённую к 1 кг газа, называют удельной газовой постоянной.
 2015-04-01
2015-04-01 15127
15127








