Задачи и разделы физической химии.
Современное определение физической химии – это наука, объясняющая химические явления и устанавливающая их общие закономерности на основе принципов физики и с использованием физических экспериментальных методов.
Важнейшая проблема современной физической химии – установление связи между строением вещества и его реакционной способностью. Первый учебник по физической химии был издан Нернстом в 1893 году, он назывался “Теоретическая химия на основе правила Авогадро и термодинамики”.
При изучении физико-химических явлений применяют следующие методы:
- Квантово-механический метод, использующий понятие дискретности энергии, а также другие ее свойства, относящиеся к элементарным частицам;
- Термодинамический (феноменологический) метод, основанный на нескольких законах, обобщающих опытные данные. Он позволяет выяснить свойства системы, не используя сведения о строении молекул или механизме процессов;
- Статистический метод, объясняющий свойства веществ, состоящих из большого числа частиц (макроскопические свойства), исходя из свойств отдельных частиц (микроскопические свойства) и их распределения в соответствии с теорией вероятности.
|
|
|
Основными разделами физической химии являются:
1. Строение вещества;
2. Химическая термодинамика (сюда включаются три закона термодинамики, учение о химическом и фазовом равновесии, учение о растворах);
3. Электрохимия;
4. Химическая кинетика и катализ
Термин термодинамика был введен в середине XIX века и происходит от двух греческих слов “термо” – температура и “динамика” – работа. Химическая термодинамика изучает законы взаимного превращения различных видов энергии, состояние равновесия, а также возможность, направление и предел протекания самопроизвольных процессов. Вопрос о скорости протекания химических процессов термодинамика не рассматривает. Химическая термодинамика основана на трех законах (постулатах), иначе называемых началами термодинамики. Эти законы не доказываются, а являются обобщением множества опытных данных, накопленных человечеством. На основе этих законов получены многочисленные следствия, которые лежат в основе строгого описания окружающего нас мира.
Термодинамическая система – это совокупность материальных объектов, выбранных нами произвольно для изучения, которая отделена от всего окружающего (называемого внешней средой) некоторой границей (условной или реальной).
Изолированная система – это система, которая не может обмениваться с окружающей средой ни веществом, ни энергией и имеет постоянный объем.
|
|
|
Закрытая система – это система, которая не может обмениваться с окружающей средой веществом (т.е. имеет постоянную массу), но может обмениваться энергией (в форме теплоты или работы).
Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией.
Кроме того, системы могут быть гомогенными (однородными), которые состоят из одной фазы, и гетерогенными(неоднородными), состоящими из двух или более фаз.
Термодинамические параметры состояния системы – (температура, объем, давление и т.д.) – это определенные измеряемые свойства системы, характеризующие ее состояние.
Состояние системы – это совокупность термодинамических параметров системы.
Параметры состояния связаны между собой (в явном или неявном виде) так называемым уравнением состояния. Например, для идеального газа уравнением состояния является уравнение Менделеева-Клапейрона, которое для 1 моль газа имеет вид: pV = RT, или 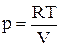 , или f (p,V,T) = 0.
, или f (p,V,T) = 0.
Различают: экстенсивные и интенсивные свойства
1. Экстенсивные свойства, зависят от массы системы (V, m, U, H и т. д.) и обладают аддитивностью: свойство системы равно сумме свойств ее частей.
2. Интенсивные свойства, не зависят от массы системы (T, p, m, r и т. д.). Эти свойства не суммируются, а выравниваются.
Важными в термодинамике являются понятия функции состояния и функции процесса.
Функция состояния – это такое термодинамическое свойство системы, величина которого целиком определяется данным состоянием системы, а ее изменение в каком-либо процессе (т.е. при переходе системы из одного состояния в другое) не зависит от пути перехода, а определяется только конечным и начальным состоянием.
Примеры функций состояния: внутренняя энергия U, энтальпия Н = U + pV, энтропия S, энергия Гельмгольца F= U - TS, энергия Гиббса G = H - TS.
Функция состояния Z обладает следующими свойствами:
1. Пусть Z = Z(х,у), тогда dZ – бесконечно малое изменение функции Z – является полным дифференциалом, что можно записать математически:
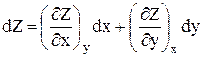
2. 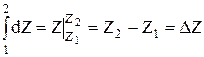 .
.
Т.е. определенный интеграл от полного дифференциала dZ не зависит от пути интегрирования.
3. 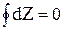 . Интеграл по замкнутому контуру от dZ равен нулю.
. Интеграл по замкнутому контуру от dZ равен нулю.
Функции процесса (F) зависят от пути перехода из одного состояния в другое. Они не имеют полного дифференциала. Их бесконечно малую величину (количество) обозначают dF, причем
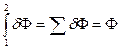 и
и 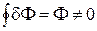 .
.
Функциями процесса являются например работа (А) и теплота (Q).
Термодинамический процесс – это изменение состояния системы, сопровождающееся изменением хотя бы одного из параметров состояния (свойств системы).
Изменение состояния системы может происходить при различных условиях, поэтому различают:
1) Равновесные и неравновесные процессы.
Равновесные процессы- это процессы, проходящие через непрерывный ряд равновесных состояний.
Равновесное состояние системы – состояние, не изменяющееся во времени и не требующее для своего поддержания воздействия каких-либо внешних факторов.
Неравновесные процессы — это процессы, после протекания которых систему нельзя вернуть в исходное состояние без того, чтобы в ней не осталось каких-либо изменений..
2). Обратимые и необратимые процессы.
Обратимые процессы – это процессы при протекании которых система возвращается в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми.
В дальнейшем часто можно считать понятия обратимого и равновесного процесса совпадающими
3). Самопроизвольные и несамопроизвольные процессы.
Самопроизвольные – процессы, происходящие сами собой не требующие затраты энергии извне и приближающие систему к равновесию.
Несамопроизвольные – процессы, требующие затраты энергии извне.
|
|
|
Отметим некоторые частные виды процессов, с которыми в дальнейшем придётся иметь дело:
а) изотермический (T = const);
б) изобарный (p = const);
в) изохорный (V = const);
г) адиабатический (нет обмена теплотой между системой и окружающей средой);
д) изобарно-изотермический (p = const, T = const);
е) изохорно-изотермический (V = const, T = const).
Химическая реакция – это разновидность процесса, при котором наблюдается изменение химического состава системы.
Рассмотрим ещё некоторые понятия.
Энергия – мера способности системы совершать работу.
Внутренней энергией системы называется сумма всех видов энергии, за исключением кинетической энергии системы в целом и ее потенциальной энергии положения.
Полная энергия системы равна сумме ее внутренней энергии, кинетической и потенциальной энергии системы как целого.
За энергию системы в термодинамике принимается ее внутренняя энергия. Внутренняя энергия обозначается символом U. Внутренняя энергия является. экстенсивным свойством системы. Нельзя определить абсолютную величину внутренней энергии системы, поскольку неизвестна, например, внутренняя энергия при 0 К. Можно определить только изменение внутренней энергии в результате того или иного процесса (DU).В равновесном состоянии система обладает определённым запасом энергии, поэтому внутренняя энергия является функцией состояния.
Работа и теплота – две возможные формы передачи энергии от одной системы к другой.
В случае работы энергия передается путем согласованного, упорядоченного, движения частиц.
Работа обозначается символом A, при этом работа положительна (А > 0), если она совершается системой против внешних сил, и отрицательна (А < 0), если она выполняется над системой
В случае теплоты – энергия передается путем хаотического движения частиц тела.
Теплота обозначается символом Q, при этом она положительна (Q > 0), если теплота поступает в систему (такой процесс называется эндотермическим), и отрицательна (Q < 0), если теплота отводится из системы (такой процесс называется экзотермическим).
В равновесном состоянии система не обладает ни запасом теплоты, ни запасом работы, поэтому Q и A являются функциями процесса. Передача теплоты или совершение работы осуществляются лишь при взаимодействии системы с внешней средой или другой системой.
|
|
|
 2014-02-02
2014-02-02 21453
21453
