Это следствие связано с теплотами образования соединений. Теплотой (энтальпией) образования соединения называется количество теплоты, выделяемой или поглощаемой при образовании 1 моля этого соединения из простых веществ, находящихся в наиболее устойчивом состоянии при данных условиях. (Простые вещества состоят из атомов одного вида, например, N 2, Н2, О2, С, S, Fe и др.) При этом реакция может оказаться гипотетической, т.е. не протекать реально. Например, теплота образования карбоната кальция равна тепловому эффекту реакции образования одного моля кристаллического карбоната кальция из металлического кальция, углерода в виде графита и газообразного кислорода:
Са (кр) + С (графит) + 3/2 О2 (г) = СаСО3 (кр)
Теплоты (энтальпии) образования устойчивых простых веществ (N 2, Н2, О2, Fe и др.) равны нулю.
Обозначим теплоту образования вещества DНобр .
В соответствии с первым следствием из закона Гесса, по теплотам (энтальпиям) образования можно рассчитать тепловой эффект любой реакции: тепловой эффект реакции равен разности между теплотами (энтальпиями) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
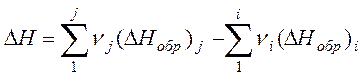 (4)
(4)
Здесь подстрочные значки j и i относятся соответственно к продуктам и исходным веществам; n - стехиометрические коэффициенты.
Cхема на Рис.4. иллюстрирует доказательство этого следствия. Уравнение (4) следует из правила сложения векторов.

Рис.4. Доказательство первого следствия из закона Гесса.
Обычно теплоты образования относят к стандартным условиям - 250С (298К) и 1 атм. (1.013 105 Па) и называют стандартной теплотой (энтальпией) образования соединения и обозначают DН0обр. Величины DН0обр наиболее распространенных соединений приведены в термодинамических справочных таблицах. С их помощью рассчитываются стандартные тепловые эффекты химических реакций DН0
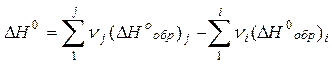 (5)
(5)
Пример: Найти стандартный тепловой эффект DН0 реакции получения кристаллического Аl2(SО4)3 при 298К из кристаллического Аl2О3 и газообразного SО3:
Аl2О3 (кр)+ 3 SО3 (газ)= Аl2(SО4)3 (кр) DН0 -?
Стандартные энтальпии образования веществ, участвующих в данной реакции, при 298 К составляют
DН0обр (Аl2О3) = −1674,0 кДж/моль,
DН0обр (SО3)= −395,4 кДж/моль,
DН0обр (Аl2(SО4)3) = −3439,3 кДж/моль,
Тогда по уравнению (5) находим
DН0 = DН0обр (Аl2(SО4)3) − DН0обр (Аl2О3) − 3DН0обр (SО3) = − 579 кДж/моль
 2015-04-01
2015-04-01 1474
1474








