Для удобства сопоставления тепловых эффектов, а также других термодинамических функций вводится представление о стандартном состоянии вещества. Для твердых и жидких веществ в качестве стандартных состояний принимаются их устойчивые состояния при внешнем давлении 1 атм и температуре 25°С (298,15К). Например, S(ромб.), С(гр), Н2О(ж). Для воды иногда гипотетически используется пар. Для газов в качестве стандартных состояний принимается состояние идеального газа при парциальном давлении 1 атм и температуре 25°С (298,15К).
Например, для реакции образования воды:
Н2 + ½ О2 = Н2О (ж) DН°298 = − 286,9 кДж/моль
Н2 + ½ О2 = Н2О (пар) DН°298 =− 242,8 кДж/моль
Верхний значок (°) указывает на стандартные состояния всех участников реакции, а нижний индекс 298 – на то, что реакции проводятся при стандартной температуре. Иногда нижний индекс опускается.
Все компоненты взяты здесь в стандартных состояниях. Различие DН° воды и пара определяется тепловым эффектом фазового перехода жидкой воды при р =1атм в гипотетический пар при 1 атм. и 298К.
Рассмотрим иллюстрацию закона Гесса еще на одном примере.
Известно:
1) С (графит) +О2 = СО2; DН01 = − 395018 Дж;
2) СО + ½ О2 = СО2 DН02 = − 284080 Дж;
Найти DН0 для следующих реакций:
3) С (графит) + ½ О2 = СО; DН03 =?
4) С (графит) + СО2 = 2СО DН04 =?
На основании исходных данных удобно составить схему возможных путей образования СО2:
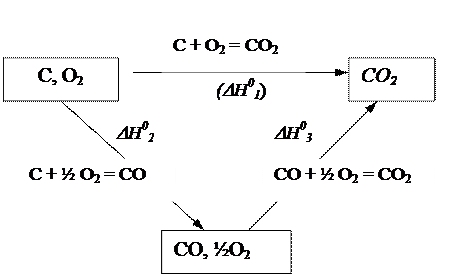
По закону Гесса
DН03 = DН01 - DН02
К такому же результату можно прийти, учитывая, что уравнение реакции (3) можно получить, вычитая из уравнения (1) уравнение (2). Аналогичная операция с тепловыми эффектами даст
DН03 = DН01 − DН02 = - 110930 Дж.
Для получения уравнения (4) надо вычесть из уравнения (1) уравнение (2), умноженное на 2. Поэтому
DН04 = DН01 − 2DН02 = 173342 Дж.
Таким образом, с уравнениями реакций можно проводить простейшие математические операции – складывать их, вычитать, умножать на коэффициент. Цель этой процедуры – получить путем такого комбинирования реакцию с неизвестным тепловым эффектом. Для получения величины этого эффекта необходимо проделать аналогичные операции и с тепловыми эффектами реакций. Вместе с тем, надо учитывать, что при изменении направления реакции на противоположное знак теплового эффекта также меняется на противоположный.
Для практического использования важны следствия из закона Гесса. Рассмотрим два из них.
 2015-04-01
2015-04-01 1539
1539
