Дифференцируя по температуре (при постоянном давлении) равенство
DН = Н2 − Н1
получаем
¶(DН)/¶T = (¶Н2/¶T)p – (¶Н1/¶T)p (7)
Здесь DН – тепловой эффект химической реакции, а индексы 1 и 2 относятся соответственно к продуктам реакции и исходным веществам.
Здесь полезным может быть напоминание определения такой характеристики вещества, как теплоемкость. Теплоемкость (с) – количество теплоты, которое надо подать системе, чтобы увеличить ее температуру на один градус. Единица измерения теплоёмкости в системе СИ — Дж/К. Удельная теплоемкость – теплоемкость единицы массы вещества. Единица измерения теплоёмкости в системе СИ — Дж/(кг× К). В химии теплоемкость принято относить к моль вещества; при этом ее единицы измерения - Дж/(моль× К).
Так как производная (¶ Н /¶T)p является теплоемкостью системы при постоянном давлении
(¶Н/¶T)p = ср,
то выражение (7) можно переписать
¶(DН)/¶T = ср 2 − ср1
или, вводя обозначения
ср 2 − ср1 = Dср,
¶(DН)/¶T = Dср (8)
Здесь D ср – изменение изобарной теплоемкости системы в химической реакции при постоянной температуре.
Для реакции, представленной в общем виде,
a A + b В = c C + d D
величина D ср будет равна
Dср = (c·ср (C) + d·ср (D)) − (a·ср (A) + b ср (B)) (9)
Здесь a, b, c и d - стехиометрические коэффициенты в уравнении реакции с участием веществ A, B, C и D.
Для изохорного процесса можно получить таким же путем аналогичное выражение:
¶(DU)/¶T = DсV (10)
Где
DсV = (c·сV (C) + d·сV (D)) − (a·сV (A) + b·сV (B))
Уравнения (7) и (8) выражают закон Кирхгофа в дифференциальной форме, который может быть сформулирован следующим образом: Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса.
Практически приходится чаще использовать закон Кирхгофа в интегральном виде. Для того, чтобы получить это выражение, разделим переменные и проинтегрируем выражения (8) и (10). Тогда тепловые эффекты при температурах Т1 и Т2 будут связаны следующими выражениями:
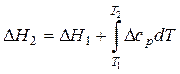 при р= const, (11)
при р= const, (11)
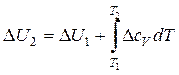 при V= const (12)
при V= const (12)
Если пренебречь изменением теплоемкостей исходных веществ и продуктов в интервале температур от Т1 до Т2, то величины Dср и DсV можно вынести за знак интеграла как константы. При этом выражения (11) и (12) упростятся до следующих:
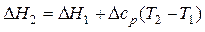 при р= const, (13)
при р= const, (13)
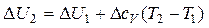 при V= const (14)
при V= const (14)
Если в качестве Т1 выбрать стандартную температуру (Т1 =298К), то зависимости теплового эффекта от температуры (11-14) будут выглядеть следующим образом (11а-14а):
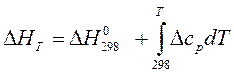 при р= const, (11а)
при р= const, (11а)
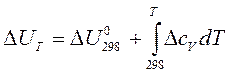 при V= const (12а)
при V= const (12а)
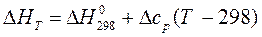 при р= const, (13а)
при р= const, (13а)
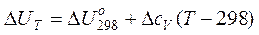 при V= const (14а)
при V= const (14а)
]
Пример:
Определить тепловой эффект DН2 реакции
3С2Н2 = С6Н6
при 750С, зная, что при 170С DН1 = − 549,4 кДж/моль(С6Н6), а средние мольные изобарные теплоемкости бензола и ацетилена в этом интервале температур соответственно равны 134,4 Дж/К и 43,8 Дж/К.
Решение:
Пользуясь уравнением (9) определяем
Dср = 134,4 − 3 43,8 = 3 Дж/ K
Применяя уравнение (13) и выражая DН2, получаем:
DН2 = − 549400 + 3(75-17) = − 549226 Дж/моль
Если необходимо учесть изменение теплоемкости с температурой, следует воспользоваться приближенными эмпирическими уравнениями вида
ср = а + b Т + c Т 2 (15)
или
ср = а + b Т + c’ Т -2. (16)
Здесь а, b и с (или c’) – эмпирические коэффициенты, которые приведены для каждого вещества в термодинамических таблицах. (Вообще теплоемкость может быть выражена формулами, включающими температуру в любых степенях.) Изменение теплоемкости в химической реакции Dср будет описываться следующим выражением:
Dср= Da + DbT + DсТ 2
или
Dср= Da + DbT + Dс’Т -2 (17)
Здесь:
Dа = (c·a(C) + d · a(D)) − (a · a(A) + b · a(B))
Db = (c·b(C) + d · b(D)) − (a · b(A) + b · b(A))
Dc = (c·c(C) + d · c(D)) − (a · c(A) + b · c(A))
Dc’= (c·c’(C) + d · c’(D)) − (a · c’(A) + b · c’(B))
В этих выражениях a, b, c и d, стоящие в начале каждого из произведений, – коэффициенты в уравнении химической реакции
a A + b В = c C + d D,
a(A), b(A), c(A), и c’(A) –упомянутыевыше коэффициенты для теплоемкости в уравнениях (15, 16) для вещества А,
a(B),, b(B),, c(B),, и c’(B) – эти же коэффициенты для вещества В,
a(C), b(C), c(C), и c’(C) – эти же коэффициенты для вещества C,
a(D), b(D), c(D), и c’(D) – эти же коэффициенты для вещества D.
Подставляя выражение (17) в уравнение (8) и интегрируя от Т1 до Т2, получаем выражение для теплового эффекта DН(Т2) с учетом зависимости изобарных теплоемкостей от температуры:
DНТ2 = DНТ1 + Dа(Т2 - Т1)· + Db (Т22 – Т12) /2 −Dc’(Т2 -1- Т1 -1)
Пример:
Найти тепловой эффект химической реакции DН
Fe2O3 + 2Al = Al2O3 + 2Fe
при 923К, используя следующие данные по теплоемкости:
ср (Al) = 10,2 + 1,213·10-2T (Дж/моль·К);
ср (Al2O3) = 110 + 1,775·10-2T – 3,1·106T-2 (Дж/моль·К);
ср (Fe) = 17,35 + 2,68·10-2T (Дж/моль·К);
ср (Fe2O3) = 113,5 + 6,73·10-2T – 1,775·106T-2 (Дж/моль·К).
Стандартный тепловой эффект реакции равен (− 1,698)·106 Дж.
Решение:
Найдем коэффициенты D а, Db и Dс’ для данного химического уравнения.
D а = 0,8;
Db = 2,021·10-2
Dс’ = − 1,325·106
Используем уравнение:
DН(Т) = DН0298 + Dа(Т − 298 )· + Db (Т2 – 2982 ) /2 - Dc’(Т -1 − 298-1)
DН923 = (− 1,698)·106 + 0,8·625 · + 1,01·10-2 · 7,64·105 − 1,325·106·2,38·10-3 = − 1,69·106 Дж.
 2015-04-01
2015-04-01 1868
1868
