Относительное содержание компонентов в паре, как правило, отличается от их содержания в растворе – пар относительно богаче компонентом, температура кипения которого ниже. Этот факт отражен в первом законе Коновалова:
Насыщенный пар по сравнению с равновесным раствором обогащён тем компонентом, температура кипения которого ниже. Добавление этого компонента к жидкому раствору понижает температуру кипения раствора при некотором постоянном давлении (или, что то же самое - повышает общее давление пара над раствором).
На различии составов раствора и равновесного с ним пара основано разделение компонентов растворов с помощью перегонки. Для рассмотрения равновесия в таких системах удобно пользоваться диаграммами состояния раствор – пар в координатах температура кипения – состав или давление пара – состав.
Рассмотрим диаграммы состояния бинарного жидкого раствора, компоненты которого неограниченно растворимы друг в друге и не образуют азеотропную смесь (системы 1-го типа). (Об азеотропных смесях – смотри далее)
При рассмотрении процесса перегонки раствора при постоянном давлении используется диаграмма состояния в координатах температура кипения – состав, изображённая на рисунке 12.
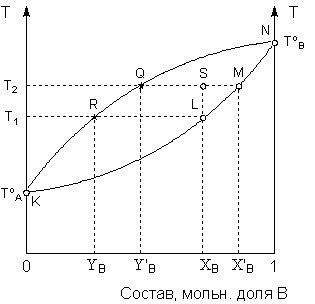
Рис. 12. Диаграмма состояния системы 1-го типа в координатах температура–состав (р =const)
Кривая KLMN представляет собой зависимость температуры начала кипения от состава раствора; под кривой находится область, отвечающая жидкой фазе. Кривая KRQN представляет собой зависимость температуры кипения раствора от состава пара; над кривой находится область, отвечающая газообразной фазе. Область между кривыми – область гетерогенности системы.
Как видно из диаграммы, раствор состава ХВ начинает кипеть при Т1 (точка L), а находящийся с ним в равновесии пар имеет состав YB (точка R), т.е. пар обогащен по сравнению с жидкой фазой компонентом A, добавление которого к раствору понижает температуру начала кипения раствора. Диаграмма состояния позволяет не только определить состав равновесных фаз, но и рассчитать их относительные количества. Рассмотрим систему общего состава ХВ, находящуюся при температуре Т2 (точка S). Равновесная жидкая фаза (точка M) будет иметь состав Х'В, а равновесный пар – состав Y'В (точка Q). Относительные количества фаз определяются по правилу рычага: в данном случае количество жидкой фазы (в молях, поскольку состав выражен в мольных долях) будет относиться к количеству пара, как длина отрезка |QS| относится к длине отрезка |SM|.
Таким образом, диаграмма состояния позволяет определить состав фракции, отгоняющейся из раствора состава ХВ в интервале температур от Т1 до Т2. Очевидно, что в этом случае состав фракции будет находиться между YВ и Y'В, т.е. отогнанная фракция будет обогащена по сравнению с исходным раствором компонентом A. Если сконденсированный пар подвергнуть повторной перегонке, будет получена фракция, ещё более обогащённая компонентом A. В результате многократного повторения таких операций может быть получен чистый компонент A. Разделение компонентов жидкого раствора, имеющих различные температуры кипения, за счёт многократного повторения циклов испарение – конденсация называется ректификацией. Схематически процесс ректификации показан на рисунке 13.

Рис. 13. Ректификация растворов летучих жидкостей.
При перегонке исходного раствора состава Хo состав раствора непрерывно изменяется, и температура кипения повышается. При перегонке в интервале температур от Тo до Т1 состав равновесного пара также изменяется от Yo до Y1; его конденсацией будет получена жидкая фракция состава в Х2 (состав усреднен), кипящая при температуре Т2. Перегонкой её в интервале температур от Т2 до Т3 после конденсации пара будет получена фракция состава Х4, кипящая при температуре Т4. Перегоняя последнюю в интервале температур от Т4 до Т5, получают фракцию состава Х6. Состав и температура кипения данной фракции уже довольно близки к чистому компоненту A. Количество необходимых для полного разделения компонентов раствора циклов испарение – конденсация (число теоретических тарелок ректификационной колонны) определяется природой компонентов (прежде всего разностью их температур кипения) и желаемой степенью чистоты получаемого ректификата и может быть рассчитано с помощью диаграммы состояния системы.
Примеры диаграмм состояния смесей 2-го типа, характеризующихся экстремумом, показаны на рисунке 14.
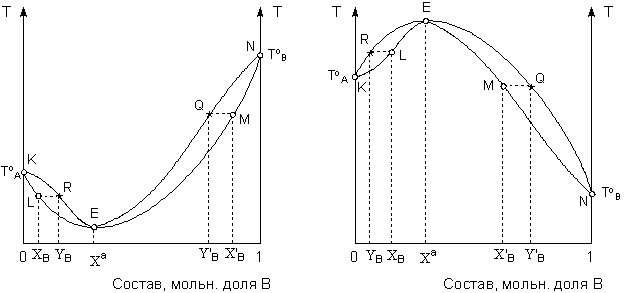
А) Б)
Рис.14. Диаграммы состояния раствор–пар для летучих растворов 2-го типа в координатах температура кипения – состав для систем с минимумом (А) и максимумом (Б) температуры кипения.
Растворы 2-ого типа называются азеотропными. Состав, соответствующий экстремумам (минимуму или максимуму) называются составом азеотропного раствора. В точках, соответствующих минимуму или максимуму, состав пара совпадает с составом жидкости (второй закон Коновалова). Температура кипения азеотропных растворов при постоянном внешнем давлении неизменна, и состав раствора при перегонке не изменяется (как у индивидуальных веществ). Диаграмму состояния системы 2-го типа в принципе можно рассматривать как совокупность диаграмм состояния двух систем первого типа, в каждой из которых в роли одного из компонентов выступает азеотропная смесь. Анализ диаграммы состояния таких систем аналогичен таковому для систем 1-го типа.
Как видно из Рис.14, полное разделение подобных систем перегонкой невозможно. При фракционной перегонке системы с минимумом температуры кипения (рис. 14-А) состав дистиллята постепенно приближается к азеотропному. Жидкий остаток при этом обогащается тем компонентом, который в исходном растворе находился в избытке по сравнению с составом азеотропной смеси – компонентом А в области концентраций левее азеотропного состава и компонентом B в области концентраций правее азеотропного состава. В системах с максимумом температуры кипения (рис. 14-В), напротив, дистиллят обогащается компонентом, который находился в избытке по отношению к азеотропному раствору, а состав кубового остатка постепенно приближается к азеотропному.
Следует, однако, помнить, что отождествление азеотропной смеси с индивидуальным веществом является условным. При изменении внешнего давления происходит смещение экстремума на кривой зависимости температуры кипения от состава (в некоторых случаях может произойти исчезновение экстремума). Следовательно, составы азеотропных растворов для жидких смесей данных компонентов при разных давлениях различаются. Так, для системы этанол – вода мольная доля этанола в азеотропе составляет 0.895 при давлении, равном 760 мм рт. ст., и 0.996 – при 100 мм рт. ст.
 2015-04-01
2015-04-01 4344
4344
