Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
С усилением металлических свойств соответствующих химических элементов усиливаются и основные свойства их оксидов и гидроксидов.
Для s- и р-элементов по периоду слева направо они изменяются от ярко выраженных основных свойств у соединений щелочных и щелочноземельных металлов до амфотерных у металлов, стоящих ближе к линии, разделяющей металлы и неметаллы (у алюминия, германия, сурьмы, свинца). Так, например, свежеосажденный гидроксид алюминия легко растворяется в растворах как кислот, так и щелочей:
Аl(ОН)3 + 3HCl = AlCl3 + 3H2O;
Аl(ОН) 3 + 3КОН = К3 [Аl(ОН) 6].
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твердыми основаниями при повышенной температуре (при сплавлении). Для проведения такой реакции смесь исходных твердых веществ нагревают до определенной температуры. При этом образуются иные, чем при реакции в водном растворе, продукты реакции. Например, при сплавлении гидроксида хрома(III) с гидроксидом, оксидом или карбонатом калия получается соль метахромовой кислоты НСЮ2 — метахромит калия:
Сr(ОН)3 + КОН =t KСrO2 + 2Н2О↑;
2Cr(ОН)3 + К2O =t 2КСrO2 + 3H2O↑;
2Сr(ОН)3 + 2СO3 =t 2КСrO2 + 3H2O↑ + CO2↑.
Оксиды щелочных и щелочноземельных металлов активно реагируют с водой с образованием растворимых гидроксидов:
К2O + Н2O = 2КОН;
ВаО + Н2O = Ва(ОН)2.
По группе сверху вниз металлические свойства s- и р-элементов усиливаются, и, соответственно, нарастают основные свойства их оксидов и гидроксидов. Так, например, в группе IIA оксид и гидроксид бериллия проявляют амфотерные свойства — легко растворяются в растворах кислот и щелочей:
ВеО + 2HCI = ВеС12 + Н2O;
ВеО + Н2O + 2NaOH = Na2[Be(OH) 4].
Соответствующие соединения бария и радия имеют ярко выраженные основные свойства:
ВаО + Н2O = Ва(ОН)2;
Ва(ОН)2 + 2HNO3 = Ba(NO3)2 + 2Н2O.
Существенное влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления атома металла: с увеличением степени окисления атома металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6:
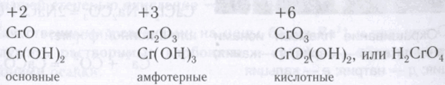
Кислотно-основные свойства этих оксидов изменяются от основных (у СrО и Сr(ОН)2) через амфотерные (у Сr2O3 и Сr(ОН) 3) до кислотных (у СrO3 и Н2СrO4). Аналогичная зависимость наблюдается и для других d-металлов.
Глюкоза - альдегидоспирт, имеет группы спиртов -ОН и альдегидную -СОН.
Химические свойства:
1. Горение (реакция с кислородом) образует углекислый газ и воду
2. Брожение (катализатор - дрожжи) образует спирт этиловый и углекислый газ
3. Реакции, характерные для многоатомных спиртов и альдегидов
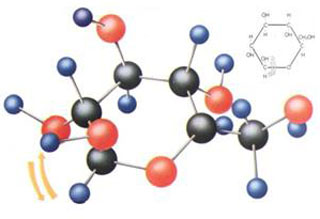
Состав глюкозы выражается молекулярной формулой С6Н1206.
Ее структурная формула
Глюкоза содержит в составе молекул альдегидную группу и пять гидроксильных групп.
Модель молекулы глюкозы:
 2015-04-06
2015-04-06 547
547








