Окислительно-восстановительными называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Степень окисления – это тот условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов. Процесс отдачи электронов называют окислением, в результате которого повышается степень окисления восстановителя. Восстановление – процесс присоединения электронов к окислителю, приводит к понижению степени окисления последнего. Окисление и восстановление – взаимосвязанные процессы, протекают в единстве, поэтому число отданных восстановителем электронов равно числу принятых окислителем. Перемещение электронов отражают электронными уравнениями.
О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя. Атом элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства.
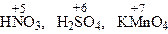 - проявляют только окислительные свойства.
- проявляют только окислительные свойства.
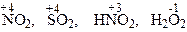 - проявляют окислительные и восстановительные свойства.
- проявляют окислительные и восстановительные свойства.
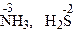 - проявляют только восстановительные свойства
- проявляют только восстановительные свойства
Пример: Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
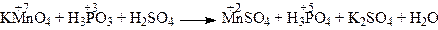
Решение. Атомы элементов, изменившие значения степеней окисления, участвуют в переносе электронов от восстановителя к окислителю. Составляем электронные уравнения. Общее число электронов участвующих в реакции равно наименьшему общему кратному для отданных и принятых электронов.



 Р+3 –2ē → Р+5 2ē · 5 процесс окисления
Р+3 –2ē → Р+5 2ē · 5 процесс окисления
10ē
 Mn+7 + 5ē → Mn+2 5ē · 2 процесс восстановления
Mn+7 + 5ē → Mn+2 5ē · 2 процесс восстановления
Р+3 – восстановитель, Mn+7 – окислитель.
Коэффициенты (5 для Р+3 и Р+5, 2 для Mn+7 и Mn+2) получены делением общего числа электронов на число отданных или принятых электронов:
10ē: 2ē = 5, 10ē: 5ē = 2. Все остальные коэффициенты находим подбором. Уравнение имеет вид:
2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
окислитель восстановитель
 2015-04-30
2015-04-30 978
978








