Таких способов существует множество, но чаще всего используется 6 перечисленных ниже. Символом X будет обозначаться формула того вещества, концентрация которого определяется данным выражением (Х =NaCl, H2SO4, KOH и т.д.)
I. Массовая доля (w) - это отношение массы растворенного вещества к общей массе раствора:
w (X) = 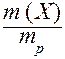 ;
;
Массовая доля - безразмерная величина. Сумма массовых долей всех веществ в растворе = 1. Массовая доля может быть выражена в процентах. В этом случае она находится по формуле:
w (X) = 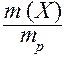 × 100,
× 100,
II. Мольная доля (х) - отношение количества вещества Х (моль) к общему числу молей всех веществ в растворе.
х (Х) = 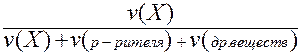 .
.
Массовая доля - безразмерная величина. Сумма мольных долей всех веществ в растворе = 1.
III. Массовая концентрация (Т) - отношение массы компонента Х к объему раствора.
Т(Х) = 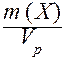 .
.
Обычно Т находят в единицах (г/дм3), в системе СИ она имеет единицу измерения (кг/м3). В аналитической химии эта величина выражается в единицах (г/см3) и называется титром вещества Х.
IV. Молярная концентрация (молярность) c(Х) или [X] - отношение количества вещества к объему раствора.
c(Х) = [X] = 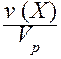 .
.
Обычно молярность выражают в (моль/дм3) и обозначают буквой (М). В системе СИ молярность имеет единицу измерения моль/м3.
V. Моляльность (b) - отношение количества вещества Х к массе растворителя в данной порции раствора.
b(X) = 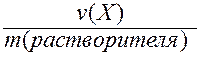 .
.
Моляльность может иметь только одну единицу измерения - моль/кг.
VI. Молярная концентрация эквивалента c(Э) - отношение количества вещества эквивалента к объему раствора:
c(Э) = c(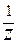 X) =
X) = 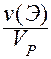 =
= 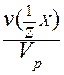 =
= 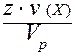 .
.
Ранее для обозначения этого понятия использовались синонимы: эквивалентная концентрация, нормальная концентрация, нормальность (все они считаются устаревшими).
Молярная концентрация эквивалента обычно выражается в единицах моль/дм3. В СИ она имеет единицу измерения моль/м3.
 2015-04-30
2015-04-30 955
955








