Данный метод применяется для составления уравнений ОВР в водных растворах с участием электролитов.
В этом методе не используется понятие степень окисления, а рассматривается обмен электронами между реальными частицами, присутствующими в растворе - ионами и молекулами. Метод полуреакций позволяет использовать в качестве исходных неполные схемы реакций.
К недостаткам этого метода следует отнести его некоторую громоздкость и ограниченность в применении только растворами электролитов.
Алгоритм применения метода полуреакций (электронно - ионного баланса)
1. Написать схему реакции. Схема может быть полной или неполной. В случае использования неполной схемы из продуктов реакции необходимо знать только частицу, в которую перешел окислитель и частицу, в которую перешел восстановитель в ходе ОВР.
Пример:
а) полная схема реакции:
Na2Cr2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O;
б) неполная схема этой же реакции, достаточная для применения метода полуреакций:
Na2Cr2O7 + K2SO3 + H2SO4 ® Cr+3 + SO  +....
+....
Пока для простоты будем использовать полную схему взаимодействия. Применение метода полуреакций к неполным схемам рассмотрено в конце этой главы.
2. Написать ионную схему реакции. При этом, на ионы разбиваются только сильные электролиты, хорошо растворимые в воде (как при составлении обменных ионных уравнений):
2Na+ + Cr2O 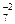 + 2K+ + SO
+ 2K+ + SO  + 2H+ + SO
+ 2H+ + SO  ®
®
2Cr+3 + SO  + 2K+ + SO
+ 2K+ + SO  + 2Na+ + SO
+ 2Na+ + SO  + H2O.
+ H2O.
Примечание. Стехиометрические коэффициенты перед ионами можно не указывать. Они не имеют никакого смысла, так как данное выражение является схемой, а не уравнением реакции:
Na+ + Cr2O 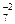 + K+ + SO
+ K+ + SO  + H+ + SO
+ H+ + SO  ®
®
Cr+3 + SO  + K+ +SO
+ K+ +SO  + Na+ + SO
+ Na+ + SO  + H2O.
+ H2O.
3. Сравнить правую и левую части ионной схемы и найти частицы, изменившие свою химическую форму.
Под изменением химической формы подразумевается:
а) изменение заряда частицы;
б) изменение формульного состава частицы.
Примечание. В данном пункте частицы H+, OH- и H2O не рассматриваются.
SO  ® SO
® SO  (произошло изменение формульного состава частицы);
(произошло изменение формульного состава частицы);
Сr2O 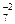 ® Cr+3 (произошло изменение как формульного состава, так и заряда частицы).
® Cr+3 (произошло изменение как формульного состава, так и заряда частицы).
4. Составить уравнения полуреакций окисления и восстановления. Это делается в такой последовательности.
а) уравниваются правые и левые части полуреакций по всем атомам, кроме кислорода и водорода:
SO  ® SO
® SO  ,
,
Cr2O 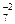 ® 2Cr+3,
® 2Cr+3,
б) полуреакции уравниваются по кислороду и водороду с учетом кислотности среды (далее будет рассмотрено отдельно)
SO  + H2O ® SO
+ H2O ® SO  + 2H+,
+ 2H+,
Cr2O 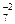 + 14 H+ ® 2Cr+3 + 7H2O,
+ 14 H+ ® 2Cr+3 + 7H2O,
в) полуреакции уравниваются по зарядам с помощью электронов. В первой полуреакции суммарный заряд частиц слева = -2, а справа = 0. Значит, справа нужно прибавить 2 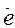 (или слева отнять 2
(или слева отнять 2 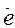 ):
):
SO  + H2O - 2
+ H2O - 2 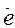 = SO
= SO  + 2H+.
+ 2H+.
Для уравнивания второй полуреакции слева нужно прибавить 6 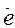 :
:
Cr2O 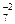 + 14H+ + 6
+ 14H+ + 6 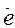 = 2Cr+3 + 7H2O.
= 2Cr+3 + 7H2O.
Полученные выражения являются уравнениями полуреакций.
5. Сделать электронный баланс, то есть подобрать коэффициенты, на которые необходимо умножить полуреакции окисления и восстановления, чтобы количество электронов, ушедших от восстановителя было равно числу электронов, пришедших к окислителю:
SO  + H2O - 2
+ H2O - 2 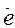 = SO
= SO  + 2H+ 3
+ 2H+ 3
Cr2O 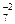 + 14H+ + 6
+ 14H+ + 6 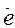 = 2Cr+3 + 7H2O 1
= 2Cr+3 + 7H2O 1
6. Умножить верхнее и нижнее уравнения полуреакций на коэффициенты электронного баланса. Затем сложить их и получить сокращенное ионное уравнение ОВР. В данном примере полуреакцию окисления нужно умножить на 3, а полуреакцию восстановления - на 1. После сложения получаем:
3SO  + 3H2O + Cr2O
+ 3H2O + Cr2O 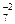 + 14H+ = 3SO
+ 14H+ = 3SO  + 6H+ + 2Cr+3 + 7H2O.
+ 6H+ + 2Cr+3 + 7H2O.
Далее сокращаем (по Н2О и Н+):
3SO  + Cr2O
+ Cr2O 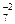 + 8H+ = 3SO
+ 8H+ = 3SO  + 2Cr+3 + 4H2O.
+ 2Cr+3 + 4H2O.
Данное выражение является сокращенным ионным уравнением взаимодействия между восстановителем (SO  ) и окислителем (Cr2O
) и окислителем (Cr2O 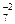 ) в кислой среде.
) в кислой среде.
Если необходимо получить молекулярное уравнение реакции, то следует выполнить еще один пункт.
7. Сокращенное ионное уравнение сложить с дополнительным ионным уравнением и получить полное ионное уравнение, которое затем преобразовать в молекулярное уравнение ОВР.
3SO  + Cr2O
+ Cr2O 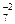 + 8H+ = 3SO
+ 8H+ = 3SO  + 2Cr+3 + 4H2O,
+ 2Cr+3 + 4H2O,
6K+ + 2Na+ + 4SO  = 6K+ + 3SO
= 6K+ + 3SO 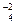 + 2Na+ + SO
+ 2Na+ + SO 
6K+ + 3SO  + 2Na+ + Cr2O
+ 2Na+ + Cr2O 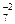 + 8H+ + 4SO
+ 8H+ + 4SO  =
=
= 6K+ + 3SO  + 2Cr+3 + 3SO
+ 2Cr+3 + 3SO  + 4H2O + 2Na+ + SO
+ 4H2O + 2Na+ + SO  .
.
3K2SO3 + Na2Cr2O7 + 4H2SO4 = Cr2(SO4)3 + 3K2SO4 + Na2SO4 + 4H2O.
Примечание. В целях экономии времени полное ионное уравнение ОВР обычно не пишут, а при сложении сокращенного ионного с дополнительным ионным уравнением сразу же получают молекулярное уравнение.
Уравнивание полуреакций по кислороду и водороду с учетом кислотности cреды
Как известно, в растворе среда может быть кислой, щелочной или нейтральной.
Примечание. Если среда в растворе слабокислая (рН немного меньше 7) или слабо щелочная (рН немного больше 7) уравнивание производят, считая среду практически нейтральной.
I. Среда кислая (рН << 7). Для составления полуреакции разрешены частицы только 2-х видов: это ион Н+ и молекула Н2О.
Полезно запомнить следующую схему:
2H+ + O* ~ H2O.
По элементному составу 2 иона Н+ и один атом “связанного” кислорода (О*) эквивалентны одной молекуле воды. Под “связанным” кислородом понимается атом кислорода, входящий в состав любой кислородсодержащей частицы (например: в молекуле СО2 два “связанных” кислорода, а в ионе SO  - их четыре).
- их четыре).
Пример 1. SO  ® SO
® SO  .
.
Ион SO  содержит 3 О*, а ион SO
содержит 3 О*, а ион SO  содержит 4 О*. Чтобы уравнять по кислороду, слева следует добавить 1 молекулу Н2О. При этом справа должно появиться 2 иона Н+ (чтобы сошлось по водороду):
содержит 4 О*. Чтобы уравнять по кислороду, слева следует добавить 1 молекулу Н2О. При этом справа должно появиться 2 иона Н+ (чтобы сошлось по водороду):
SO  + H2O ® SO
+ H2O ® SO  + 2H+.
+ 2H+.
Пример 2. Cr2O 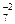 ® 2Cr+3.
® 2Cr+3.
Слева 7 атомов кислорода, а справа - ни одного. Слева добавляем 14 Н+, при этом справа появляется 7 Н2О.
Пример 3. NO 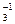 ® NH
® NH 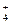 .
.
Cлева следует добавить 10 Н+. Из них 6 Н+ “свяжут” 3 кислорода в 3 молекулы воды, а 4 Н+ необходимы для получения иона аммония:
NO 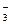 + 10 H+ ® NH
+ 10 H+ ® NH 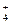 + 3H2O.
+ 3H2O.
Примечание. Полученные в этих примерах схемы полуреакций не являются уравнениями. Далее их следует уравнять по зарядам с помощью электронов.
II. Среда щелочная (рН >> 7). В данном случае для уравнивания по кислороду и водороду можно использовать только ионы ОН- и молекулы Н2О. Между этими частицами имеет место следующее соотношение (по элементному составу):
2OH- ~ H2O + O*.
Пример 1. SO  ® SO
® SO  ,
,
SO  + 2OH- ® SO
+ 2OH- ® SO  + H2O.
+ H2O.
Пример 2. CrO  ® Cr+3,
® Cr+3,
CrO  + 4H2O ® Cr+3 + 8OH-.
+ 4H2O ® Cr+3 + 8OH-.
Пример 3. MnO2 ® MnO  ,
,
MnO2 + 4OH- ® MnO  + 2H2O.
+ 2H2O.
Пример 4. N2H4 ® N2,
N2H4 + 4OH- ® N2 + 4H2O.
III. Среда нейтральная (рН» 7). Для уравнивания по кислороду и водороду в схеме полуреакции слева можно писать только Н2О. Справа могут появиться или Н+ или OH-.
Пример 1. SO  ® SO
® SO  ,
,
SO  + H2O ® SO
+ H2O ® SO  + 2H+.
+ 2H+.
Обратите внимание: в данном случае схема реакции совпадает с таковой для случая кислой среды.
Пример 2. NO 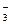 ® NO
® NO 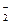 ,
,
NO 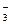 + H2O ® NO
+ H2O ® NO 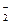 + 2OH-.
+ 2OH-.
Полученное выражение аналогично переходу нитрата в нитрит в щелочной среде.
Применение метода полуреакций для неполных схем
Рассмотрим следующий пример: к раствору KMnO4 добавили несколько капель H2SO4 (т.е. создали кислую среду), а затем добавили раствор Na2SO3. Составить уравнение ОВР. Условие задачи можно записать в виде схемы:
KMnO4 + Na2SO3 + H2SO4 ®....
или в ионном виде:
K+ + MnO 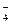 + 2Na+ + SO
+ 2Na+ + SO  + 2H+ + SO
+ 2H+ + SO  ®....
®....
Из литературы известно, что ион MnO 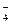 является довольно сильным окислителем в любых средах. В кислой среде (в нашем случае) имеет место переход: MnO
является довольно сильным окислителем в любых средах. В кислой среде (в нашем случае) имеет место переход: MnO 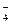 ® Mn+2.
® Mn+2.
Так же известно, что SO  в любых средах склонен проявлять восстановительные свойства. Причем, независимо от cреды сульфит переходит в сульфат: SO
в любых средах склонен проявлять восстановительные свойства. Причем, независимо от cреды сульфит переходит в сульфат: SO  ® SO
® SO  .
.
Напишем уравнения соответствующих полуреакций и сделаем электронный баланс:
MnO 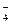 + 8H+ + 5
+ 8H+ + 5 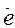 = Mn+2 + 4H2O 2
= Mn+2 + 4H2O 2
SO  + H2O - 2
+ H2O - 2 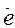 = SO
= SO  + 2H+ 5
+ 2H+ 5
Умножим уравнения полуреакций на коэффициенты электронного баланса и сложим. После сокращения одинаковых ионов получим сокращенное ионное уравнение ОВР:
2MnO 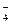 + 16 H+ + 5H2O = 2Mn+2 + 8H2O + 5SO
+ 16 H+ + 5H2O = 2Mn+2 + 8H2O + 5SO  + 10 H+,
+ 10 H+,
2MnO 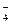 + 6 H+ + 5SO
+ 6 H+ + 5SO  = 2Mn+2 + 3H2O + 5SO
= 2Mn+2 + 3H2O + 5SO  .
.
Напишем снизу дополнительное ионное уравнение:
2MnO 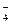 + 6 H+ + 5SO
+ 6 H+ + 5SO  = 2Mn+2 + 3H2O + 5SO
= 2Mn+2 + 3H2O + 5SO  .
.
2K+ + 3SO  + 10Na+ = 2SO
+ 10Na+ = 2SO  + 10Na+ + 2K+ + SO
+ 10Na+ + 2K+ + SO  .
.
Далее получаем молекулярное уравнение ОВР:
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 3H2O + 5Na2SO4 + K2SO4.
 2015-04-30
2015-04-30 10830
10830








