Теоретические основы. Процесс разрушения веществ под действием окружающей среды называется коррозией. Коррозия делится на химическую (разрушение металлов в агрессивной среде) и электрохимическую. При контакте двух металлов во влажном воздухе возникают микрогальванические пары, приводящие к протеканию электрохимической коррозии металлов. В процессе электрохимической коррозии более активный металл, имеющий более отрицательное значение стандартного электродного потенциала, отдает электроны и переходит в раствор. Электроны от него перемещаются к менее активному металлу и участвуют в восстановительных процессах ионов и молекул, находящихся в окружающей микрогальваническую пару среде.
В кислых растворах идет процесс водородной деполяризации: 2Н+ + 2е 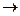 Н2
Н2 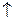
В нейтральных и щелочных средах идет процесс с участием растворенного кислорода воздуха - кислородная деполяризация: О2 + 2Н2О + 4е 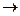 4ОН
4ОН 
 Пример Коррозия контакта Cu / Zn, среда - КОН.
Пример Коррозия контакта Cu / Zn, среда - КОН.
Zn: Zn - 2e 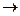 Zn2+
Zn2+ 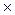 2
2
Cu: О2 + 2Н2О + 4е 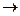 4ОН
4ОН 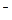
 1
1
 |
Zn+O2+2H2O 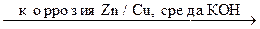 2Zn(OH)2
2Zn(OH)2
Цель работы. Изучение различных случаев коррозии металлов и методов защиты от коррозии.
Порядок работы.
Опыт 1. Коррозия оцинкованного и луженого железа
Зачистите наждачной бумагой две железные проволочки. Прикрепите к одной из них гранулу цинка, а к другой - гранулу олова. Опустите проволочки в отдельные пробирки. В каждую пробирку добавьте по 2-3 мл дистиллированной воды, 5 капель 2N раствора серной кислоты и 1 каплю раствора гексацианоферрата (III) калия K3[Fe(CN)6]. Сравните изменения в обеих пробирках.
Примечание. Гексацианоферрат (III) калия K3[Fe(CN)6] используют для качественной реакции на ион Fe2+. В присутствии ионов двухвалентного железа образуется темно-синий осадок KFe[Fe(CN)6].
Опыт 2. Коррозия железа в присутствии меди
В стакан объемом 50 мл налейте дистиллированную воду, растворите в ней немного хлорида натрия (катализатор коррозии), добавьте 1 мл раствора гексацианоферрата (III) калия и несколько капель раствора фенолфталеина. Опустите в стакан перевитые медную и железную проволочки. Через несколько минут отметьте наблюдаемые явления.
Опыт 3. Катализаторы (стимуляторы) коррозии
Налейте в пробирку 2 мл 2N раствора соляной кислоты и опустите в нее алюминиевую проволочку. Идет ли реакция? Добавьте в пробирку небольшое количество кристаллического хлорида натрия. Запишите наблюдения.
Опыт 4. Защита от коррозии. Оксидирование
Зачистите наждачной бумагой 2 железных гвоздя и один из них поместите на 5 минут в пробирку с концентрированной азотной кислотой. Промойте гвозди водой и опустите их в стакан с разбавленной серной кислотой. Сравните интенсивность выделения газа в обоих случаях.
Опыт 5. Защита от коррозии. Ингибирование
В две пробирки поместите немного железных опилок, добавьте в одну из них 1 мл раствора формалина (СН2О) и прилейте в каждую пробирку по 2 мл разбавленной соляной кислоты. Сравните интенсивность выделения газа в каждой пробирке.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Номер и название опыта.
4. Значения стандартных электродных потенциалов металлов, катод и анод микрогальванической пары.
5. Уравнения электрохимических процессов, идущих на аноде и на катоде.
6. Наблюдения и обсуждения.
7. Выводы.
Типовые задачи.
1. Написать уравнения химических реакций, протекающих при коррозии следующих сплавов (контактов): а) Cu/Cr, среда HCl; б) Zn/Al, среда KOH; в) Fe/Sn, среда H2O; г) Ag/Cu, среда H2SO4; д) Fe/Zn, среда KCl; е) Mg/Zn, среда NaOH.
2. Предложить анодное покрытие для защиты цинка от коррозии. Обосновать и указать достоинства и недостатки способа.
3. Предложить катодное покрытие для защиты меди от коррозии. Обосновать и указать достоинства и недостатки способа.
 2015-04-30
2015-04-30 2676
2676
