Теоретические основы. При пропускании электрического тока через растворы или расплавы электролитов на электродах происходят окислительно-восстановительные процессы, называемые электролизом.
В растворах или расплавах электролита, например МХ, происходит процесс электролитической диссоциации:
МХ 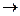 Ма+ + Ха
Ма+ + Ха 
Образующиеся ионы под действием сил электростатического притяжения перемещаются к противоположно заряженным электродам, где участвуют в окислительно-восстановительных процессах. В них могут также участвовать ионы водорода (в кислой среде) и молекулы воды.
Процессы, проходящие на катоде (отрицательно заряженном электроде). Этот электрод имеет избыток электронов, на нем происходят процессы восстановления:
а). Восстановление катиона металла (или катиона водорода): Ма+ + а е 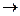 М0
М0
2Н+ + 2е 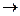 Н2
Н2 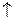
б). Восстановление молекул воды:
2Н2О + 2е 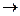 Н2
Н2 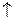 + 2ОН
+ 2ОН 
Если металл в ряду напряжений стоит после олова (Sn), в кислой среде - после водорода, то возможен только процесс восстановления металла (водорода) (а).
Если металл в ряду напряжений стоит до алюминия (Аl), то возможен только процесс восстановления молекул воды (б).
Если металл в ряду напряжений стоит между алюминием и оловом, то оба процесса идут одновременно.
Если электролизу подвергается раствор смеси солей (и кислот), то первыми на катоде будут восстанавливаться менее активные ионы (стоящие правее в ряду напряжений).
Процессы, проходящие на аноде (положительно заряженном электроде). На этом электроде существует недостаток электронов, поэтому идут процессы окисления, в которых могут участвовать ионы соли, молекулы воды и непосредственно анод.
а). Если анод растворимый (металлический, кроме анодов, изготовленных из золота и платины), то идет процесс окисления (растворения) анода: 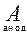 - m e
- m e  Am+
Am+
б). Если анод нерастворимый (неметаллический, в частности угольный, а также золотой или платиновый), а анион представляет собой остаток бескислородной кислоты (Сl  ; Br
; Br  ; I
; I  ; S2
; S2  ), кроме аниона F
), кроме аниона F  , то идет процесс окисления аниона, например, 2Сl
, то идет процесс окисления аниона, например, 2Сl  + 2е
+ 2е  Cl2
Cl2 
в). Если анод нерастворимый (неметаллический, в частности угольный, а также золотой или платиновый), а анион имеет сложный состав (SO42  ; NO3
; NO3  ) или F
) или F  , то идет процесс окисления молекул воды (в щелочной среде - гидроксильных групп ОН
, то идет процесс окисления молекул воды (в щелочной среде - гидроксильных групп ОН  ): 2Н2О - 4е
): 2Н2О - 4е  О2
О2  + 4Н+
+ 4Н+
4ОН  - 4е
- 4е  О2
О2  + 2Н2О
+ 2Н2О
Пример. Электролиз раствора нитрата калия на медном аноде.
Диссоциация раствора нитрата калия: KNO3  K++NO3
K++NO3 
Катод: K+; H2O.
Процесс, происходящий на катоде: 2Н2О+2е  Н2
Н2 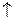 +2ОН
+2ОН 
Анод: NO3  , H2O, анод медный - растворимый.
, H2O, анод медный - растворимый.
Процесс, происходящий на аноде: 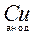 - 2e
- 2e 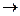 Cu2+
Cu2+
В общем виде, уравнивая число электронов, участвующих в процессах окисления и восстановления, процесс электролиза нитрата калия на медном аноде можно записать в следующем виде:
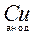 +2Н2О
+2Н2О 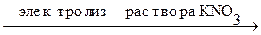 H2
H2  +Cu(OH)2
+Cu(OH)2
Количественно электролиз описывается законами Фарадея: 1. Масса выделяющегося на электроде вещества пропорциональна количеству электричества, протекающего через раствор: m = kIt = kQ, где k - коэффициент пропорциональности, I - сила тока, протекающего через раствор, t - время электролиза (сек), Q - количество электричества (Q=It).
2. Для выделения на электроде 1 эквивалента любого вещества необходимо затратить одно и то же количество электричества, равное числу Фарадея: F = 96500 Кл 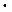 моль
моль  1. Обобщая оба закона Фарадея, можно записать: m =
1. Обобщая оба закона Фарадея, можно записать: m = 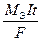
Реально выделяющееся при электролизе количество вещества меньше, чем рассчитанное теоретически по вышеприведенной формуле. Выход по току: h = 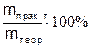
Цель работы. Изучить электролиз раствора сульфата меди на медном аноде, рассчитать выход по току.
Порядок работы.
1. Зачистите наждачной бумагой медный электрод и измерьте его массу с точностью до 0,01 г.
2. Присоедините медные электроды к источнику постоянного тока (электрод с известной массой - к катоду), опустите электроды в стакан с раствором сульфата меди.
3. Включите секундомер одновременно с источником тока. Установите и поддерживайте силу тока 2,5 А в течение всего времени электролиза (время электролиза указывает преподаватель).
4. По окончании электролиза отключите источник тока, отсоедините катод, промойте его в ацетоне и высушите в токе теплого воздуха, держа в 30-40 см над газовой горелкой.
5. Охладите катод до комнатной температуры и определите его массу после электролиза.
6. Рассчитайте теоретический выход меди и выход по току.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Электрохимические процессы, происходящие при электролизе раствора сульфата меди на медном аноде.
а) сила тока I =......
б) время электролиза t =....
в) масса катода до электролиза m1 =....
г) масса катода после электролиза m2 =....
5. Расчеты:
а) практический (экспериментальный) выход меди mпракт.=....
б) теоретический выход меди (рассчитывается по формуле закона Фарадея) mтеор. =....
в) выход по току h =....
Типовые задачи.
1. Написать уравнения реакций, протекающих при электролизе расплавов следующих электролитов с инертным анодом: а) CuCl2; б) K2S; в) NaOH; г) AlF3.
2. Написать уравнения реакций, протекающих при электролизе растворов следующих электролитов: а) CuSO4, анод инертный; б) NiCl2, анод Au; в) Na2SO4, анод C; г) AgNO3, анод Cu; д) KCl, анод Al.
3. В каком порядке будет проходить восстановление ионов на катоде при электролизе водного раствора, содержащего смесь нитратов серебра, никеля и натрия?
4. Какое количество электричества потребуется для выделения из раствора: а) 2 г водорода; б) 2,25 л кислорода (н.у.)?
5. Какой объем кислорода (условия нормальные) выделится при пропускании тока силой 6 А в течение 30 мин. через водный раствор гидроксида калия?
6. Сколько времени потребуется для полного разложения 2 моль воды током силой 2 А?
7. При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (н.у.). Какой объем водорода, измеренный в тех же условиях, выделится на катоде?
8. За 10 мин. Из раствора хлорида платины ток силой 5 А выделил 1,517 г металла. Вычислить молярную массу эквивалента платины и установить состав соли.
9. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин. на катоде выделилось 1,071 г металла. Вычислить молярную массу металла.
10. При электролизе раствора нитрата серебра током силой 7,0 А в течение 8,5 мин. масса катода увеличилась на 2,59 г. Найти выход по току.
11. При электролизе раствора сульфата меди током силой 87,0 А в течение 68,5 мин. масса катода увеличилась на 0,72 г. Найти выход по току.
 2015-04-30
2015-04-30 6463
6463
