1. Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
2. Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Все реальные процессы протекают с конечной скоростью. Они сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. Следовательно, все они неравновесны и необратимы.
Необратимость возникает только в том случае, если частиц много. Если мы имеем систему из большого числа частиц – появляются другие новые законы. Если заснимем движение частицы на пленку, то в любом направлении просмотра всё будет нормально для нас. Если заснимем растворение кристалла и посмотрим в обратном направлении – понятно, что такого не бывает. Для рассмотрения необратимых процессов нужны системы из б.ч.ч. Движение одной частицы обратимо, а группы частиц – необратимо. Для описания системы из б.ч.ч. можно использовать термодинамический или статический метод.
· При термодинамическом методе не важен состав. Важно, как меняется система при действии на нее. Уравнение теплового баланса и уравнение Менделеева-Клапейрона достигло этого подхода. Алгебраическая сумма всех количеств теплоты (поглощенных и выделенных) в теплоизолированной системе равна нулю. Q1+ Q2+…+ Qn= 0, где n – количество тел системы. Q = сm(t2 – t1), где m – масса тела, кг; (t2 – t1) – разность температур тела,° С (или К); с – удельная теплоёмкость вещества, из которого состоит тело. Термодинамика – описательная наука, позволяет исключить невозможные сценарии развития в системе.
· Статическая физика. P=nkT, где k – постоянная Больцмана. (pV=nRt) Давление в газе объяснено упругими соударениями молекул со стенками сосуда 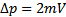 – импульс. Статистический подход позволяет понять, что такое давление и абсолютная температура. Абсолютный 0 температур – прекращается всякое движение молекул.
– импульс. Статистический подход позволяет понять, что такое давление и абсолютная температура. Абсолютный 0 температур – прекращается всякое движение молекул. 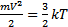 - кинетическая энергия связана с температурой. Молекулы обладают разными скоростями. Если бы скорость была равна 0 – вся атмосфера лежала бы на Земле. Если бы скорости молекул ограничены были, то атмосфера обрывалась бы
- кинетическая энергия связана с температурой. Молекулы обладают разными скоростями. Если бы скорость была равна 0 – вся атмосфера лежала бы на Земле. Если бы скорости молекул ограничены были, то атмосфера обрывалась бы 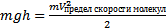 . Атмосфера меняется постепенно, давление уменьшается с высотой. Концентрация молекул и давления в атмосфере станет равным нулю только на бесконечной высоте. Если есть молекулы разных масс: самые легкие будут легче улетать. Водород улетел из атмосферы почти весь. Тяжелые молекулы ближе к Земле. g – постоянна только на небольших расстояниях от Земли. Если расстояние больше вместо g используют
. Атмосфера меняется постепенно, давление уменьшается с высотой. Концентрация молекул и давления в атмосфере станет равным нулю только на бесконечной высоте. Если есть молекулы разных масс: самые легкие будут легче улетать. Водород улетел из атмосферы почти весь. Тяжелые молекулы ближе к Земле. g – постоянна только на небольших расстояниях от Земли. Если расстояние больше вместо g используют 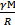 .
. 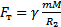 ;
; 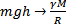 . То как ведет себя атмосфера зависит от массы планеты. Маленькие быстрее теряют атмосферу. Скорости молекул простираются от нуля до бесконечности. При хаотическом движении распределение скоростей молекул можно определить (вывел Максвелл).
. То как ведет себя атмосфера зависит от массы планеты. Маленькие быстрее теряют атмосферу. Скорости молекул простираются от нуля до бесконечности. При хаотическом движении распределение скоростей молекул можно определить (вывел Максвелл).
· Функция распределения Максвелла. Пусть имеется n тождественных молекул, находящихся в состоянии беспорядочного теплового движения при определенной температуре. После каждого акта столкновения между молекулами, их скорости меняются случайным образом. В результате невообразимо большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным. В результате каждого столкновения проекции скорости молекулы испытывают случайное изменение на Δυx, Δυy, Δυz, причем изменения каждой проекции скорости независимы друг от друга. Будем предполагать, что силовые поля на частицы не действуют. Найдем в этих условиях, каково число частиц d n из общего числа n имеет скорость в интервале от υ до υ+Δυ. Скорость – векторная величина. Для проекции скорости на ось х (x -й составляющей скорости) из имеем 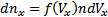 , тогда
, тогда 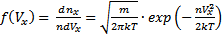 . Вероятность того, что молекула обладает скоростью в интервале (Vx;Vx+dVx), будет равна
. Вероятность того, что молекула обладает скоростью в интервале (Vx;Vx+dVx), будет равна 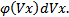 Кол-во молекул конечно, а скоростей бесконечно.
Кол-во молекул конечно, а скоростей бесконечно. 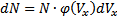 - число молекул со скоростью в интервале (Vx;Vx+dVx). Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x-компонента скорости лежит в интервале от υх до υх+dυх; y-компонента, в интервале от υy до υy+dυy; z-компонента, в интервале от υz до υz+dυz будет равна произведению вероятностей каждого из условий (событий) в отдельности:
- число молекул со скоростью в интервале (Vx;Vx+dVx). Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x-компонента скорости лежит в интервале от υх до υх+dυх; y-компонента, в интервале от υy до υy+dυy; z-компонента, в интервале от υz до υz+dυz будет равна произведению вероятностей каждого из условий (событий) в отдельности: 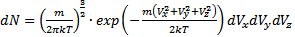 , где (Vx; Vx+dVx); (Vy; Vy+dVy); (Vz; Vz+dVz) – число молекул, которые одновременно обладают скоростью в интервалах.
, где (Vx; Vx+dVx); (Vy; Vy+dVy); (Vz; Vz+dVz) – число молекул, которые одновременно обладают скоростью в интервалах.
| Этой формуле можно дать геометрическое истолкование: d nxyz – это число молекул в параллелепипеде со сторонами dυx, dυy, dυz, то есть в объёме d V =dυxdυydυz, находящемся на расстоянии V от начала координат в пространстве скоростей. |
Если собрать вместе все молекулы в единице объёма, скорости которых заключены в интервале от υ до υ+dυ по всем направлениям, и выпустить их, то они окажутся через одну секунду в шаровом слое толщиной dυ и радиусом υ (рис. 2.4). Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше.
Объём этого шарового слоя 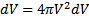 . Общее число молекул в слое, как следует из
. Общее число молекул в слое, как следует из 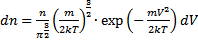 . Нас интересует только распределение только по величине скорости:
. Нас интересует только распределение только по величине скорости: 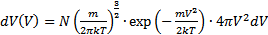 , где f(Vx), f(Vy), f(Vz) – f зависит от величины и направления.
, где f(Vx), f(Vy), f(Vz) – f зависит от величины и направления.
В системах из б.ч.ч. всё равно поддерживается равновесие. С точки зрения механики нельзя эту систему назвать равновесной (сумма сил равна 0, сумма моментов сил равна 0 должна быть) – механическое равновесие. В термодинамике – термодинамическое равновесие: система, находящаяся в термодинамическом равновесии, если ответственные за обмен с внешней средой характеристики имеют одинаковые значения в системе и во внешней среде. Еще есть химическое равновесие. Есди система теплоизолирована, то не будет переноса тепла и выравнивания не будет.
27. Открытые и закрытые системы.
Изолированная система – ничем не могут обмениваться.
Закрытая система – могут обмениваться энергией, но не могут веществом (тут устанавливается равновесие, направление t выравнивается). Понятие равновесия – не потоков.
Открытая система – могут обмениваться и энергией, и веществом (живые системы всегда открытые).
В химическом равновесии химические потенциалы должны быть одни (отсутствие градиентов химических потенциалов).
В физике 19 века считали, что нет необратимых процессов. В конце 19 века после теории теплопроводности описали выравнивание температуры. И задумались, что необратимые процессы есть. Часто механически нельзя описать все процессы.
 2015-04-30
2015-04-30 7119
7119
