дщ
2. САМА ИЗ УЧЕБНИКА
3. Ката́лиз(греч. κατάλυσιςвосходит кκαταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК или их комплексы, ускоряющие химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам.
Общие св-ва -
К ферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекуламисубстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферменты способны оказывать действие в ничтожно малых концентрациях (например, одна молекула фермента реннина, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин притемпературе 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции с высокой константой равновесия и отрицательной величиной ΔG принято называть экзергоническими. Реакции с низкой константой равновесия и соответственно положительной величиной ΔG (они обычно не протекают спонтанно) называются эндерго-ническими. Для начала и завершения этих реакций необходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническими реакциями, обеспечивая последние необходимым количеством энергии.
1. Не расходуются в процессе реакции.
2. Оказывают свое действие при малых концентрациях.
3. Не оказывают влияния на величину константы равновесия реакции.
4. Их действие подчиняется закону действующих масс.
5. Не ускоряют термодинамически невозможных реакций.
4. ––
БИЛЕТ 4.
Ароматические гетероциклические соединения
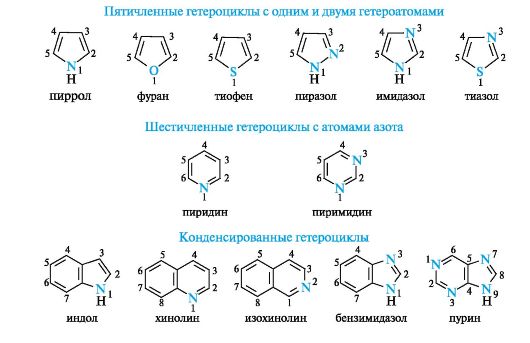
На примере пиримидина, имидазола, пурина.
Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.
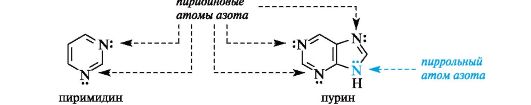
Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N-9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2).
Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
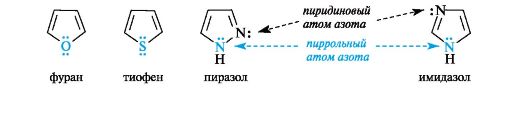
В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару и-электронов, а пиридиновый - один p-электрон.
2. Втори́чная структу́ра белка́ — пространственная структура, образующаяся в результате взаимодействия между функциональными группами пептидного остова
Регулярными называются вторичные структуры, образованные аминокислотными остатками с одинаковой конформацией главной цепи (углы φ и ψ), при разнообразии конформаций боковых групп.
К регулярным вторичным структурам относят:
· спирали, которые могут быть левозакрученными и правозакрученными с разным периодом и шагом. Большинство спиральных структур в полипептидных цепях поддерживается внутримолекулярными водородными связями. Водородная связь при этом образуется между карбонильной группой одного аминокислотного остатка иаминогруппой другого, лежащего ближе к N-концу полипептида[2]. Разные типы спиралей описываются цифровой записью вида ab, где a — номер по цепи аминокислотного остатка, который предоставляет аминогруппу для формирования водородной связи, b — количество атомов в цикле, замкнутом водородной связью. К спиральным структурам, которые встречаются в белках, относятся:
· α-спираль, или спираль 413, — самая распространённая в белках вторичная структура. Данная спираль характеризуется плотными витками вокруг длинной оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[3] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
· 310-спираль — очень «тугая» спираль, в сечении имеет форму треугольника, в белках встречается в основном её правая форма, и то только в виде 1-2 витков[2].
· π-спираль, или спираль 516, — спираль с широкими витками, в результате в центре спирали остаётся пустое пространство. В белках встречается редко, обычно не более одного витка.
· β-листы (β-структура, складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[3]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Полипептидные цепи в составе β-листов могут быть направлены N-концами в противоположные стороны (антипараллельная β-структура), в одну сторону (параллельная β-структура), также возможно существование смешанной β-структуры (состоит из параллельной и антипараллельной β-структуры)[2]. Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин иаланин. β-структура является второй по частоте встречаемости в белках после α-спирали.
· полипролиновая спираль — плотная левая спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется в полипептидных цепях богатых пролином, где формирование насыщенной системы водородных связей по этой причине невозможно. Полипролиновая спираль типа poly(Pro)II реализуется в коллагене, при этом три левых полипролиновых спирали перевиваются в правую суперспираль, которая стабилизируется водородными связями между отдельными цепями[2].
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
· водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
· стэкинг-взаимодействия;
· электростатические взаимодействия;
· Ван-дер-Ваальсовы взаимодействия.
Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных ее участках (любой участок белка имеет вторичную структуру). Если Вы забыли о том, какие бывают вторичные структуры, о силах, стабилизирующих эти структуры, загляните в любой учебник по биохимии. Выделяют надвторичные структуры - термодинамически или кинетически стабильные комплексы альфа-спиралей и бета-структур, формирующиеся за счет межрадикальных взаимодействий. Определенные характерные сочетания альфа-спиралей и бета-структур часто обозначают как «структурные мотивы». В глобулярных белках обнаружены, например, складка Россмана (βαβαβ-элемент, т. е. 2 сегмента α-спирали, вставленные между тремя параллельными β-цепями), β-меандр (слой из трех антипараллельных β-цепей, «Меандр» - название очень извилистой реки в Греции). Например триозофосфатизомераза и один домен пируваткиназы имеют супервторичную структуру в виде β-бочонка. Структурный мотив «α-спираль-поворот-α-спираль» обнаружен во многих ДНК-связывающих белках. Более длинная α-спираль располагается в большой бороздке ДНК, а более короткая α-спираль поперек бороздки. Супервторичная структура в виде «цинкового пальца», где атом цинка связан с радикалами четырех аминокислот, также часто отмечают в ДНК-связывающих белках. Молекулы гистонов объединяются в комплексы с помощью «лейциновых застежек», в которых лейциновые остатки α-спирали одного белка взаимодействуют с помощью гидрофобных взаимодействий с лейциновыми остатками другого белка.Здесь мы рассмотрим подробнее следующие два уровня пространственной организации.
3. По учебнику
4. в кислом виде
?
 2015-04-30
2015-04-30 2932
2932








