Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора
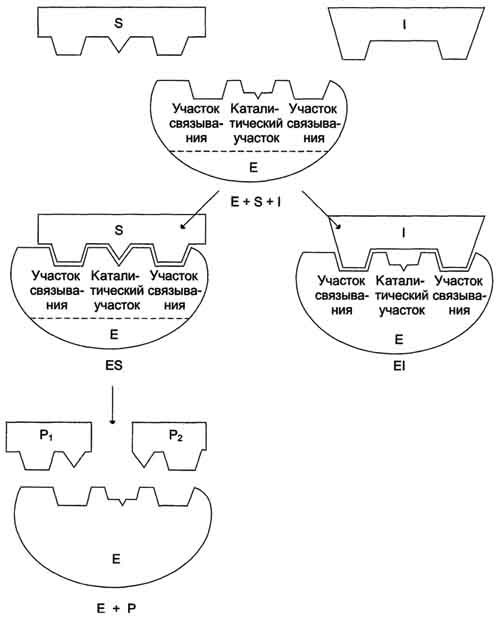
Рис. 2-21. Схема конкурентного ингибирования активности фермента.
необходима большая концентрация субстрата для достижения 1/2 Vmax.
Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом.
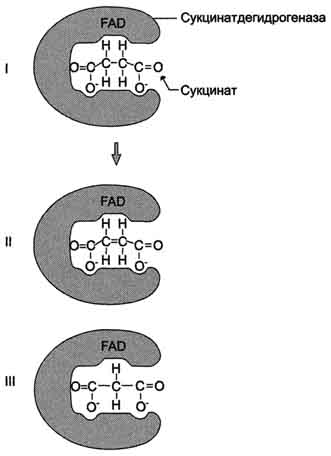
Рис. 2-22. Пример конкурентного ингибирования сукцинат-дегидрогеназы малоновой кислотой. I - сукцинат связывается с активным центром фермента сукцинатдегидрогеназы; II - в ходе ферментативной реакции происходит отщепление двух атомов водорода от сукцината и присоединение их к ко-ферменту FAD. В результате образуется фумарат, который высвобождается из активного центра сукцинатдегидрогеназы; ill - малоновая кислота - структурный аналог сукцината, она также связывается с активным центром сукцинатдегидрогеназы. При этом химическая реакция не идёт.
 2015-04-30
2015-04-30 373
373








