Каталитические реакции подчиняются общим законам химии и термодинамики, но имеют при этом свои особенности, так как в них всегда участвует один дополнительный компонент – катализатор. Действие катализаторов принципиально отличается от действия других факторов, способствующих интенсификации химических реакций, например, температуры, давления, радиационного воздействия и др. Повышение температуры может ускорять реакцию вследствие увеличения энергетического уровня реагирующих молекул, т.е. их активации за счет вводимого извне тепла. При этом изменяется внутренняя энергия системы и смещается положение равновесия.
Катализатор же не влияет ни на равновесие химической реакции, ни на все другие термодинамические характеристики реакций. Изменяя в равной степени скорость прямой и обратной реакций, катализатор способствует повышению скорости достижения равновесия при данных условиях.
Теория каталитических процессов относится к числу сложных и недостаточно полно изученных областей современной физической химии. В настоящее время еще нет общей теории, позволяющей предвидеть каталитическое действие различных веществ на ту или иную химическую реакцию. Существует несколько теорий, объясняющих механизм действия катализаторов, из которых наиболее распространенной теорией, служащей основой современных представлений о катализе, является теория промежуточных соединений. Согласно этой теории, медленную реакцию между исходными веществами можно заменить двумя или несколькими более быстрыми реакциями с участием катализатора, который образует с исходными веществами промежуточные непрочные соединения. Ускоряющее действие катализатора состоит в понижении энергии акти- вации реакций образующихся промежуточных соединений, что оказывает очень сильное влияние на скорость реакции, поскольку в уравнение Аррениуса
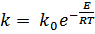
энергия активации Е входит в показатель степени. При практическом применении большое значение имеет технологическая характеристика промышленных катализаторов (активность, температура зажигания, производительность, селективность, отравляемость, прочность и др.). Наиболее важной характеристикой катализаторов является их активность, т.е. мера ускоряющего действия катализатора по отношению к данной реакции. Активность определяется уравнением
А = kк/k = ехр(DЕ/RT), (5.1)
где А – активность катализатора; k,k к – константы скорости реакции без катализатора и в присутствии катализатора; ∆Е – снижение энергии активации под действием катализатора: ∆Е = Е – Ек, где E, Eк – энергия активации реакции без катализатора и в присутствии катализатора. Ускоряющее действие катализатора можно наглядно проследить на примере окисления сернистого ангидрида
2SO2 + O2 = 2SO3 + Q.
Реакция в отсутствие катализатора протекает крайне медленно (при 420 °С, или 693 К энергия активации составляет приблизительно 420 000 Дж/моль). При проведении этой реакции на ванадиевом катализаторе (V2O5) Eк = 268000 Дж/моль⋅К, подставив эти величины в уравнение (5.1) и учитывая, что R = 8,3 Дж/моль ⋅К, получаем А = 3×1011, т.е. скорость реакции возрастает в сотни миллиардов раз.
Температурой зажигания катализатора называют минимальную температуру реагирующей смеси, при которой процесс начинает протекать с достаточной для практических целей скоростью. Чем активнее катализатор, тем ниже температура зажигания, что особенно важно при проведении экзотермических обратимых реакций, так как при этом соответственно повышается степень превращения. Для реакции А = R + Q указанное положение отражено на рис. 5.1.
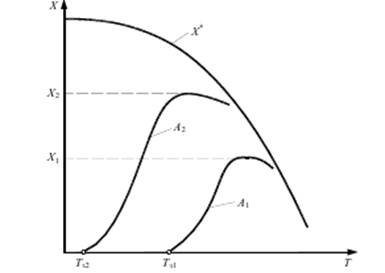
Рис.5.1 Зависимость степени превращения X экзотермической обратимой реакции от температуры Т для катализаторов различной активности при А1 < А 2
При работе на катализаторе А1 с температурой зажигания Tз1 максимальная степень превращения составляет X1. При работе на более активном катализаторе A2 с более низкой температурой зажигания Tз2 максимальная степень превращения более высокая и соответственно будет равна X2. При понижении температуры зажигания облегчается оформление каталитического процесса, так как расширяется рабочий интервал температур (между Tз и максимальной температурой), упрощается конструкция реактора, уменьшается предварительный подогрев реагентов и становится устойчивее технологический режим.
Отравление катализатора – это частичная или полная потеря его активности в результате действия посторонних примесей – контактных ядов. Отравление может быть обратимым и необратимым. При обратимом отравлении примеси снижают активность катализатора временно, пока они присутствуют в зоне катализа; после удаления ядов катализатор восстанавливает свою прежнюю активность. При необратимом отравлении активность катализатора не восстанавливается и после удаления контактных ядов из зоны реакции. Активность твердого катализатора может снижаться также вследствие уменьшения активной поверхности катализатора под воздействием, например, высоких температур, при осаждении на поверхности катализатора продуктов реакции или пыли, механического разрушения катализатора и по многим другим причинам. Важной особенностью катализаторов является их избирательность (селективность) по отношению к определенным реакциям. В сложных реакциях (параллельных и последовательных), где термодинамически возможно образование нескольких продуктов, катализатор позволяет ускорить только одну целевую реакцию; естественно, что это имеет большое практическое значение. Для сложной реакции типа
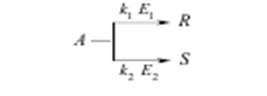
селективность выражается уравнением
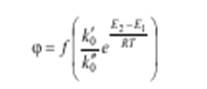
Из этого уравнения видно, что при некоторой заданной температуре Т путем подбора соответствующего катализатора можно изменять разность E2 - E1 и, таким образом, создавать возможности для получения только или главным образом целевого продукта. Примером избирательности катализатора может служить реакция окисления NH3 до NO на платиновом катализаторе
4NH 3 + 5О2 = 4NO + 6Н2О + 986 кДж,
протекающая полностью за десятитысячные доли секунды, т.е. практически мгновенно. Одновременно с указанной реакцией протекают две параллельные реакции при которых образуются N2О и N2
4NH3 + 4O2 = 2N2O + 6H2O + 1105 кДж,
4NH 3 + 3O2 = 2N 2 + 6H2O + 1269 кДж.
Эти реакции термодинамически более выгодны, поскольку они сопровождаются выделением большого количества тепла, однако практически они не протекают, поскольку в присутствии платинового катализатора их скорость неизмеримо мала.
Особенно сильно селективность проявляется в сложных органических реакциях. Так, например, этиловый спирт в зависимости от типа катализатора и условий проведения процесса катализа может превращаться в следующие продукты: этилен СН2–СН2, диэтиловый эфир СН3–СН2–О–СН2–СН3, ацетон СН3СОСН3, бутадиен СН2=СН–СН=СН2, ацетальдегид СН3СНО и другие продукты. Следовательно, применяя соответствующий катализатор, из одного и того же сырья можно получить различные целевые продукты.
В присутствии катализатора обычно снижается порядок реакции, причем, чем активнее катализатор, тем этот эффект сказывается сильнее, т.е. тем ниже порядок реакции. В связи с этим, кинетика каталитических реакций обычно описывается уравнениями, найденными эмпирически, и формальный порядок таких каталитических реакций будет выражаться как в виде целого, так и дробного числа. Влияние катализатора на порядок реакции можно проследить на примере реакции окисления SO 2
2SO 2 + O2 = 2SO3 + Q,
скорость которой без катализатора может быть выражена в виде следующего уравнения
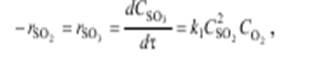 (5.2)
(5.2)
где CSO3, CSO2,CO2 – текущие концентрации. Таким образом порядок реакции п = 2 + 1 = 3. При проведении этой реакции на ванадиевом катализаторе ее скорость выражается уравнением Борескова
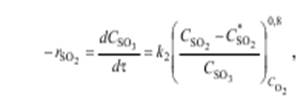 (5.3)
(5.3)
где C*SO2 – равновесная концентрация SO2. В этом случае п = 0,8 + 1 = 1,8. Для наиболее активных платиновых катализаторов справедливо уравнение Тейлора и Ленера
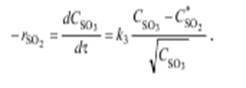 (5.4)
(5.4)
Из этого уравнения следует, что п = 1.
Таким образом, в рассмотренном примере порядок реакции снижается с 3 до 1,8 при проведении ее без катализатора и до 1 в присутствии катализатора. В гомогенно-каталитических реакциях скорость процесса зависит от концентрации не только реагирующих веществ, но и катализатора.
 2015-05-05
2015-05-05 4369
4369
