В общем случае суммарное уравнение скорости всего процесса гетерогенного катализа должно включать описание каждой из его стадий. Но точно так же, как и при протекании гетерогенного некаталитического процесса, не все его стадии оказывают равное влияние на скорость катализа. В большинстве случаев одна из стадий является наиболее медленной, лимитирующей процесс; она и определяет его скорость, поэтому для изыскания путей интенсификации такого процесса важно прежде всего установить лимитирующую стадию.
Из анализа гетерогенных некаталитических процессов известно, что если наиболее медленной стадией, лимитирующей общую скорость, является диффузионный перенос газообразного вещества через пограничный слой газа, т.е., если процесс протекает во внешнедиффузионной области, эффективным средством его ускорения служит увеличение скорости газового потока. На этом основан наиболее часто применяемый экспериментальный метод определения влияния диффузии на скорость каталитического процесса.
Для этой цели проводят серию опытов по определению скорости каталитической реакции при различной скорости потока реакционной смеси, но при постоянном отношении объема катализатора к объему смеси: Vк/Vг = const или Vк/ f ×w = const, где Vк – объем катализатора; Vг – объем реакционной газовой смеси; f – площадь сечения контактной трубки; ω – линейная скорость газового потока. При увеличении ω (что достигается уменьшением f) скорость реакции
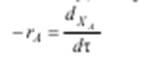
будет возрастать только до тех пор, пока процесс протекает во внешнедиффузионной области (рис. 5.3).
На участке кривой от ω = 0 до ω = ω1 скорость потока оказывает влияние на скорость реакции и, следовательно, процесс протекает во внешнедиффузионной области. Влияние внутренней диффузии исследуют путем проведения серии опытов при скорости потока ω > ω1 (в области, где внешняя диффузия уже не оказывает влияния на общую скорость процесса). Опыты проводят на зернах катализатора различного размера, результаты опытов выражают в виде графической зависимости r = j (1/R).
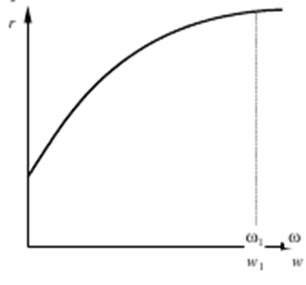
Рис.5.3 Влияние внещней диффузии (скорости потока w) на скорость каталитического процесса r
На графике эта зависимость имеет такой же характер, что и для некаталитических процессов в системе г – т (рис. 5.4).
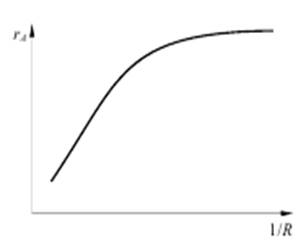
Рис.5.4 Влияние внутренней диффузии (радиуса зерен катализатора R) на скорость каталитического процесса r
Активное действие катализатора обусловлено прежде всего предварительной адсорбцией реагирующих веществ на поверхности катализатора (стадии III – V на рис. 5.2), что оказывает большое влияние на скорость гетерогенного катализа.
Адсорбция является самопроизвольным процессом, поэтому она сопровождается убылью энергии системы и связана с выделением тепла. Существует два вида адсорбции – физическая и химическая (последняя называется также активированной адсорбцией, или хемосорбцией). Процесс катализа связан с хемосорбцией, но хемосорбция может быть обратимой и необратимой. Естественно, что в процессе катализа хемосорбция должна быть обратимой, так как активные центры должны непрерывно возобновлять свою функциональную деятельность по отношению к реагентам. Необратимая адсорбция вызывает отравление катализатора.
С целью установления функциональной зависимости скорости гетерогенного катализа от различных факторов проводят всесторонние исследования, что позволяет определить влияние различных показателей на скорость адсорбции и десорбции реагентов поверхностью катализатора, а также на скорость протекания других стадий, определяющих каталитический процесс в целом. Полученные при этом данные используют для составления теоретических уравнений, позволяющих установить общие закономерности в идеальных условиях.
Для практических целей обычно применяют эмпирические уравнения, которые получают путем тщательного изучения влияния различных факторов на скорость конкретного каталитического процесса в условиях, близких к производственным. При этом идеализированные модели служат отправной точкой для наиболее эффективного анализа экспериментальных данных.
Одним из эмпирических уравнений является уравнение (5.4). Это уравнение справедливо для сравнительно узкой области изменения концентрации сернистого ангидрида и кислорода (оно применимо для газов, получаемых при обжиге в воздухе флотационного колчедана). Сейчас предложено свыше 20 эмпирических уравнений для этой же реакции. Нахождение кинетических уравнений и определение оптимальных параметров является главной целью научных исследований в области каталитических процессов, так как эти данные используются затем для расчета каталитических реакторов.
Температура оказывает весьма существенное влияние на каталитические процессы, так как при повышении температуры увеличивается константа скорости реакции и одновременно изменяется константа равновесия. Для процессов, проходящих в кинетической области, повышение температуры всегда способствует приближению процесса к состоянию равновесия. Но, как известно, при обратимых реакциях равновесная степень превращения X* при повышении Т уменьшается для экзотермических реакций и увеличивается для эндотермических реакций. Поэтому закономерности, отражающие суммарную скорость реакции и действительную степень превращения для экзотермических и эндотермических реакций, совершенно различны. При этом наблюдается такая же функциональная зависимость Х = f (Т), как и для некаталитических процессов.
Время контакта (время соприкосновения) реагирующих веществ с катализатором также является важной технологической характеристикой каталитического процесса, так как оно определяет его интенсивность. При расчете реакторов время контакта определяют по уравнению:
t = Vк /V (5.5)
где τ – время контакта; Vк – объем катализатора; V – объем реакционной смеси, проходящей через катализатор в единицу времени. Величина, обратная времени контакта, называется объемной скоростью и выражается уравнением:
S = 1/t (5.6)
где S – объемная скорость (объем реакционной смеси, проходящей через единицу объема катализатора в единицу времени), м3(газа) /м 3(катализ) ⋅ с = с –1. При увеличении объемной скорости обычно снижается степень превращения, однако при этом возрастает интенсивность работы аппарата, т.е. увеличивается количество целевого продукта, получаемого с единицы объема катализатора в единицу времени. Это объясняется тем, что при увеличении скорости потока реагирующая система в большей мере удалена от равновесия, процесс протекает в области высоких скоростей за счет большой движущей силы: DС = Рг – Рт.
В качестве примера приведем данные о влиянии объемной скорости на интенсивность каталитического процесса синтеза аммиака
N2 + 3Н2 = 2NH3, протекающего при Т = 450 К
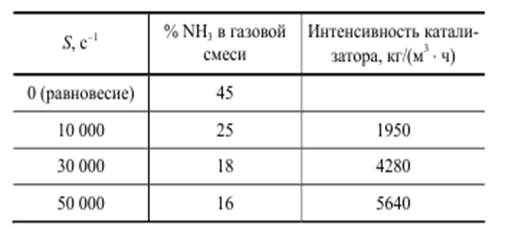
Из приведенных данных следует, что при увеличении скорости газа в 5 раз содержание NH3 в конечной смеси снижается только в 1,5 раза, а интенсивность процесса возрастает в 3 раза. Интенсивность катализатора выражают в виде уравнения
G = r×z×S, (5.7)
где G – производительность катализатора, кг/ч ⋅ м3; ρ – плотность реагента при нормальных условиях, кг /м 3 (для аммиака ρ = 0,7708 кг/м3); z – мольная доля целевого продукта в газовой смеси; S – объемная скорость, ч –1. Из уравнения (5.7) видно, что при увеличении объемной скорости производительность катализатора возрастает. Однако возможности для увеличения S ограничены, так как при этом степень превращения ХА уменьшается (снижается концентрация целевого продукта, что затрудняет выделение его из реакционной смеси), возрастает расход энергии и нарушается автотермичность экзотермической реакции вследствие относительного увеличения объема реакционной смеси.
Если проводить экзотермическую реакцию с различным временем соприкосновения реакционной смеси с катализатором τ, получают серию кривых на осях координат Т – ХА с максимальным значением Х max, что позволяет установить оптимальную температурную последовательность, обеспечивающую наиболее эффективное ведение процесса. Его следует начинать при высокой температуре, когда скорость процесса велика и, следовательно, достигается высокая интенсивность, а затем вести процесс при снижении температуры и увеличении времени соприкосновения реагирующих масс, при этом возрастает значение ХА.
Применение давления является одним из способов повышения степени превращения при промышленном осуществлении обратимых каталитических реакций, проходящих с уменьшением объема. Давление становится решающим фактором, когда активность катализатора и величина X* (равновесная степень превращения) низкие.
 2015-05-05
2015-05-05 3536
3536
