Активный транспорт — энергозависимый трансмембранный перенос против электрохимического градиента. Различают первичный и вторичный активный транспорт. Первичный активный транспорт осуществляют насосы (различные АТФазы), вторичный — симпортёры (сочетанный однонаправленный транспорт) и антипортёры (встречный разнонаправленный транспорт).
Первичный активный транспорт. Движущая сила трансмембранного переноса возникает при ферментативном гидролизе макроэргических связей АТФ. Родовой термин для таких АТФаз (например, Na+,K+-, H+,K+-, Ca2+‑АТФазы) — насосы.
Вторичный активный транспорт. Движущая сила для трансмембранного переноса одного вещества (или ионов) против электрохимического градиента возникает за счёт потенциальной энергии, запасённой за счёт сочетанного переноса ионов (как правило, Na+) по электрохимическому градиенту. В большинстве случаев поступление Na+ в цитозоль из межклеточного пространства и обеспечивает вторичный активный транспорт разных ионов и веществ. Известно 2 типа вторичного активного переноса — симпорт и антипорт (рис. 2–6).
Первичный активный транспорт обеспечивают следующие насосы — натрий, калиевые АТФазы, протонные и калиевые АТФазы, Са2+-транспортирующие АТФазы, митохондриальные АТФазы, лизосомальные протонные насосы и др.
Натрий, калиевая АТФаза (рис. 2–11) регулирует трансмембранные потоки основных катионов (Na+, K+) и опосредованно — воды (что поддерживает постоянный объём клетки), обеспечивает Na+–связанный трансмембранный перенос (симпорт и антипорт) множества органических и неорганических молекул, участвует в создании МП покоя и генерации ПД нервных и мышечных элементов.
Электрогенность. При каждом цикле гидролиза АТФ 3 иона Na+ выбрасываются из клетки, а 2 иона K+ поступают в цитозоль, суммарный эффект — выброс из клетки одного катиона. Другими словами, Na+,K+‑насос обладает электрогенностью: его работа приводит к поддержанию положительного заряда наружной (внеклеточной) поверхности мембраны.
Сердечные гликозиды (например, уабаин и дигоксин) блокируют работу Na+,K+–насоса, конкурентно с K+ взаимодействуя с участком связывания K+ на наружной поверхности мембраны. В результате при гипокалиемии (низкий [K+] плазмы крови) увеличивается токсичность сердечных гликозидов.
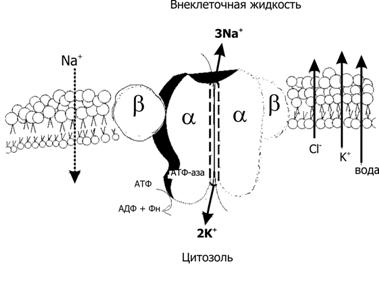
Рис. 2–11. Na+, K+ – насос [7]. Модель Na+,K+–АТФазы, встроенной в плазматическую мембрану. Na+,K+–насос — интегральный мембранный белок, состоящий из 4 СЕ (формирующие канал 2 каталитические субъединицы и 2 гликопротеина ). Na+,K+‑насос осуществляет транспорт катионов против электрохимического градиента (X) — транспортирует Na+ из клетки в обмен на K+ (при гидролизе одной молекулы АТФ 3 иона Na+ выкачиваются из клетки, и 2 иона K+ закачиваются в неё). Слева и справа от насоса при помощи стрелок показаны направления трансмембранного потока ионов и воды в клетку (Na+) и из клетки (K+, Cl– и вода) в силу различий их X. АДФ — аденозиндифосфат, Фн — неорганический фосфат.
Протонная и калиевая АТФаза (H+,K+‑насос). При помощи этого фермента париетальные клетки желёз слизистой оболочки желудка участвуют в образовании соляной кислоты (электронейтральный обмен 2 внеклеточных ионов K+ на 2 внутриклеточных иона H+ при гидролизе одной молекулы АТФ).
H+,K+‑АТФаза — гетеродимер (2 высокомолекулярных ‑СЕ и 2 меньшей мол. массы и сильно гликозилированной ‑СЕ).
‑СЕ — главный Аг, к которому при некоторых заболеваниях (например, при витамин B12–анемиях и атрофическом гастрите) в крови циркулируют АТ.
Са2+ - транспортирующие АТФазы (Са2+‑АТФазы) выкачивают ионы кальция из цитоплазмы в обмен на протоны против значительного электрохимического градиента Са2+.
Са2+ ‑ АТФазы плазмолеммы переносят ионы кальция из цитоплазмы во внеклеточное пространство в обмен на протоны (1 H+ в обмен на 1 Ca2 + при гидролизе 1 молекулы АТФ).
Са2+ ‑ АТФазы саркоплазматического ретикулума. Как и Са2+‑АТФазы плазмолеммы, Са2+-транспортирующие АТФазы саркоплазматического ретикулума откачивают ионы кальция из цитоплазмы (2 H+ в обмен на 2 Ca2 + при гидролизе 1 молекулы АТФ), но не во внеклеточное пространство, а во внутриклеточные депо кальция (в замкнутые межмембранные объёмы гладкой эндоплазматической сети, именуемой в скелетных МВ и кардиомиоцитах — саркоплазматический ретикулум). Недостаточность Са2+‑АТФазы саркоплазматического ретикулума проявляется симптомами мышечной усталости (миопатия) при физической нагрузке.
Митохондриальная АТФаза типа F (F0F1) — АТФ–синтаза внутренней мембраны митохондрий — катализируют конечный этап синтеза АТФ (рис. 2–12). Кристы митохондрий содержат АТФ-синтазу, сопрягающую окисление в цикле Кребса и фосфорилирование АДФ до АТФ. АТФ синтезируется при обратном токе протонов в матрикс через канал в АТФ-синтезирующем комплексе.
Хемиосмотическое сопряжение. Сопряжение переноса электронов и синтеза АТФ (механизм предложил Питер Митчелл в 1961 г.) обеспечивает протонный градиент. Внутренняя мембрана непроницаема для анионов и катионов. Но при прохождении электронов по дыхательной цепи ионы H+ откачиваются из матрикса митохондрий в межмембранное пространство (рис. 2–12). Эта энергия электрохимического протонного градиента и используется для синтеза АТФ и транспорта метаболитов и неорганических ионов в матрикс.
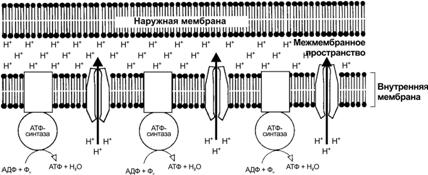
Рис. 2–12. Механизм хемиосмотического сопряжения при образовании АТФ в митохондриях [11]. При транспорте электронов по дыхательной цепи из матрикса через внутреннюю мембрану в межмембранное пространство митохондрий поступает H+. Созданный таким образом электрохимический градиент (H) позволяет АТФ-синтазе катализировать реакцию АДФ + неорганический фосфат (Фн) АТФ.
Лизосомальные протонные насосы (H+‑АТФазы типа V [от Vesicular]), встроенные в мембраны, окружающие лизосомы (также комплекс Гольджи и секреторные пузырьки), транспортируют H+ из цитозоля в эти мембранные органеллы. В результате в них понижается значение pH, что оптимизирует функции этих структур.
Транспортёры ABC (от A TP- B inding C assette — АТФ-связывающая последовательность) — либо гидролизующие АТФ насосы для активного транспорта разных ионов и молекул, либо ионные каналы или регуляторы ионных каналов. Так, ген CFTR (от cystic fibrosis transmembrane regulator — трансмембранный регулятор кистозного фиброза) кодирует структуру хлорного канала (одновременно регулятор функционирования других каналов), мутации которого приводят к развитию муковисцидоза (кистозного фиброза).
Вторичный активный транспорт. Известны 2 формы активного вторичного транспорта: сочетанный (симпорт) и встречный (антипорт) (см. рис. 2–6).
Симпорт — сочетанный перенос (котранспорт, сочетанный транспорт) — движение двух веществ сквозь мембрану при помощи одного и того же переносчика (симпортёра).
Антипорт — одновременное трансмембранное перемещение двух веществ, но в противоположном направлении (встречный транспорт) при помощи одного и того же переносчика (антипортёра, обменника).
Симпорт реализуют интегральные мембранные белки. Перенос вещества Х против его электрохимического градиента (Х) в большинстве случаев происходит за счёт поступления в цитозоль из межклеточного пространства по градиенту диффузии ионов натрия (т.е. за счёт Na), а в ряде случаев — за счёт поступления в цитозоль из межклеточного пространства по градиенту диффузии протонов (т.е. за счёт H). В итоге и ионы (Na+ или H+), и вещество Х (например, глюкоза, аминокислоты, неорганические анионы, ионы калия и хлора) перемещаются из межклеточного вещества в цитозоль.
Всасывание глюкозы происходит через верхушечные поверхности клеток, окаймляющих просвет проксимальных извитых канальцев почки и тонкого кишечника при помощи сочетанного транспорта с ионами Na+. Разные изоформы транспортёра переносят Na+ и глюкозу в соотношении 1:1 или 2:1. Расчёты показывают, что максимальная концентрация глюкозы в клетке может в 100 или в 104 раз превышать её концентрацию в плазме крови.
При стехиометрии 1:1 движущая сила равна сумме разностей электрохимического потенциала для Na+ (Na) и химического потенциала для глюкозы (глюкоза). Равновесие достигается, когда Na в одном направлении становится равным глюкоза в противоположном направлении:
 2015-05-05
2015-05-05 13363
13363
