V1=9, 6 мл
V2=10, 3 мл
V3=9, 8 мл
Vср=9,9 мл
М(1/6 K2Cr2O7)=49 г/моль
М(Na2S2O3× 5H2O)=248 г/моль
M (Na2S2O3)=158,11 г/мл
m(K2Cr2O7)= C(Na2S2O3) × V(Na2S2O3) × М(1/6 K2Cr2O7) × 100/10=0,1 ×10 ×49 ×10=490 мг =0,49 г
T (Na2S2O3/ K2Cr2O7) = 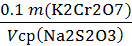 , г/мл
, г/мл
C (Na2S2O3) = 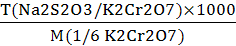 , моль/л
, моль/л
T (Na2S2O3) = 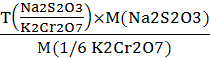 , г/мл
, г/мл
T (Na2S2O3/ K2Cr2O7) = 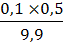 =0,005050 г/мл
=0,005050 г/мл
C (Na2S2O3)= 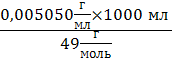 =0,1030 моль/л
=0,1030 моль/л
T (Na2S2O3) = 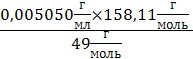 = 0,01629 г/мл
= 0,01629 г/мл
Приготовление медного щелочно-цитратного раствора(реактива Бенедикта)
Реактивы:
1. CuSO4×5H20
2. Лимонная кислота C6H8O7
3. Na2CO3
4. Дистиллированная вода
Оборудование
1. Мерная колба 250 см3
2. Химический стакан
 2015-05-05
2015-05-05 764
764








