цикл Кребса-Хензелейта, цикл мочевины), циклич. последовательность ферментативных р-ций, в результате к-рых происходит ассимиляция NH3 (в виде NH+4) и синтез мочевины (см. схему), к-рая выводится из животного организма.
Один из путей поступления 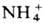 в О. ц.-р-ции пере-аминирования (трансаминирования) и окислит, дезаминирования.
в О. ц.-р-ции пере-аминирования (трансаминирования) и окислит, дезаминирования.
В печени, где осуществляется О. ц., происходит окислит, дезаминирование глутаминовой к-ты с образованием NH4+, к-рое катализируется глутаматдегидрогеназой:
НАД (НАДФ) и НАДН (НАДФН)-соотв. окисленная и восстановленная формы никотинамидадениндинуклеотида (никотинамидадениндинуклеотидфосфата) Образующийся 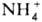 поступает в О. ц. или используется организмом для синтеза аминокислот (в результате обратимости приведенных р-ций).
поступает в О. ц. или используется организмом для синтеза аминокислот (в результате обратимости приведенных р-ций).
Из мн. периферич. тканей (в т. ч. из мозга) 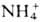 поступает в печень в виде глутамина, к-рый в отличие от глутаминовой к-ты способен легко проникать через клеточные мембраны и транспортироваться кровью в печень, где под действием глутаминазы превращ. в глутаминовую к-ту и
поступает в печень в виде глутамина, к-рый в отличие от глутаминовой к-ты способен легко проникать через клеточные мембраны и транспортироваться кровью в печень, где под действием глутаминазы превращ. в глутаминовую к-ту и 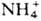 :
:
Образующийся в мышцах 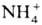 (в результате расщепления аминокислот, дезаминирования аденозинмонофосфата и др.) вступает в р-цию с 1-оксоглутаровой к-той с образованием глутаминовой к-ты, в результате переаминирования к-рой (с участием пирувата) образуется аланин. Последний поступает в печень, где в результате трансаминирования с участием 1-оксоглутаровой к-ты образуется глутаминовая к-та.
(в результате расщепления аминокислот, дезаминирования аденозинмонофосфата и др.) вступает в р-цию с 1-оксоглутаровой к-той с образованием глутаминовой к-ты, в результате переаминирования к-рой (с участием пирувата) образуется аланин. Последний поступает в печень, где в результате трансаминирования с участием 1-оксоглутаровой к-ты образуется глутаминовая к-та.
Первая стадия ассимиляции 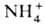 (начало О. ц.)-синтез карбамоилфосфата (см. схему, р-ция I). Р-ция необратима и катализируется карбамоилфосфат-синтетазой, к-рая активна только в присут. N-ацетилглутаминовой к-ты. Необходимый для этой р-ции СО 2 образуется в трикарбоновых кислот цикле.
(начало О. ц.)-синтез карбамоилфосфата (см. схему, р-ция I). Р-ция необратима и катализируется карбамоилфосфат-синтетазой, к-рая активна только в присут. N-ацетилглутаминовой к-ты. Необходимый для этой р-ции СО 2 образуется в трикарбоновых кислот цикле.
Константа равновесия р-ции образования цитруллина из орнитина и карбамоилфосфата (II), катализируемая орнитин-карбамоилтрансферазой, настолько велика, что орнитин практически полностью переходит в цитруллин.
Биосинтез аргининосукцината (III) катализируется арги-ниносукцинат-синтетазой, в присут. к-рой уреидогруппа активируется с участием АТФ:
А-остаток аденозина, РР-пирофосфорная к-та
Отщепление аргинина с образованием фумаровой к-ты (IV) катализируется аргининосукцинат-лиазой. Ключевое звено цепи превращений в О. ц.-гидролиз аргинина (V) на орнитин и мочевину, к-рая выводится из организма через почки. Р-ция катализируется аргиназой, к-рая активна в присут. Со 2+ или Мn2+. Т. обр., благодаря О. ц. организм освобождается от токсичных для него продуктов- 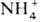 и СО 2 ("отходов" обмена в-в).
и СО 2 ("отходов" обмена в-в).
О. к.-единственное соед. с уже сформир. пиримидиновым циклом, к-рое используется для дальнейшего синтеза пиримидиновых нуклеотидов при его поступлении с пищей или с мед. препаратами (свободные урацил, цитозин и тимин не утилизируются в тканях). Синтез нуклео-тидов осуществляется путем присоединения к O.к. D-рибозил-5-фосфата, источником к-рого является 5-фосфори-бозил-1-пирофосфат. Образующийся при этом оротидин-5'-фосфат (оротидиловая к-та; VI) подвергается декарбоксилированию с образованием уридин-5'-фосфата (урациловой к-ты). Последний превращ. в уридинтрифосфат (УТФ), из к-рого образуются цитидин-трифосфат (путем замены в УТФ группы ОН в положении 4 на группу NH2) и тимидинтрифосфат (метилированием УТФ в положение 5).
О. к.-фактор роста (незаменимое пищ. в-во) для нек-рых микроорганизмов, неспособных к ее синтезу. У человека и животных осуществляется биосинтез этого соед., и поэтому O.к. не является для них витамином.
Эндогенный синтез O.к. полностью покрывает физиол. потребность в ней организма. Однако в условиях, предъявляющих повыш. требования к интенсивности синтеза нук-леотидов и нуклеиновых к-т (напр., в период интенсивного роста, после операции, кровопотерь), необходимо ее дополнит. введение.
В пром-сти O.к. получают окислением 4-метилурацила. Ее определение осуществляют микробиологически с использованием Lactobaciblus vulgaricus 09, спектрофотометрически (после предварит. выделения методами хроматографии) или ферментативными методами.
O.к. в виде оротата калия применяют в медицине при заболеваниях сердца, печени и др. случаях, связанных с нарушением белкового обмена.
14. Ферменты их роль в организме. Механизм и условия действия ферментов
Фермент-это биокатализаторы белковой природы, которые в значительной мере ускоряют ход биохимических реакций путем снижения энергии активации реагирующих веществ при умеренной температуре и физиологических значениях рН; сами ферменты при этом не расходуются. Вещества, с которыми взаимодействует фермент в процессе катализа, называются субстратами.
Механизм ферментативного катализа реализуется в 2 этапа: образование фермент-субстратного комплекса ES и образования продукта Р. Образование комплекса ES проходит через стадии образования комплексов ES1 и ES2. Схематически это можно выразить следующим образом:
E+S <-> ES1<->ES2<->E+P
Образование комплекса ES1 носит обратимый характер, т.е. ES1 может либо распадаться до свободного фермента и субстрата, либо превратиться в ES2.В свою очередь, комплекс ES2 может либо распадаться с образованием продукта и свободного фермента, либо превратиться в комплекс ES1, а затем в свободный фермент Е и субстрат S. В зависимости от констант скоростей этих реакций фермент-субстратный комплекс будет либо быстро распадаться на субстрат и фермент, либо распадаться с образованием продукта Р и свободного фермента.
Скорость ферментативных реакций зависит от химической природы реагируемых веществ, температуры, количества фермента Е, субстрата S, и рН среды.Оптимальный для ферментов температурой считается 37, нормальное атмосферное давление и показатель рН, близкий к нейтральному. С повышением температуры и давления активность многих ферментов повышается. Максимальный считается температура 45,выше которой активность резко снижается, т.к. при таких температурах структура ферментов начинает быстро разрушаться.
Ферменты усложняют реакцию, проводя ее по более сложному пути, не требующему энергетических затрат.
15. Классификация ферментов по типу химических реакций.
1)оксидоредуктазы, катализирующие окислительно-восстановительные реакции;
2)трансферазы, осуществляющие перенос групп атомов, отличных от атомов водорода;
3)гидролазы, расщипляющие связи с участием молекул воды;
4)лиазы, обеспечивающие образование двойных связей за счет удаления или добавления групп атомов;
5)изомеразы, осуществляющие внутримолекулярный перенос групп атомов и образования изомерных форм;
6)лигазы, соединяющие две молекулы с образованием связей C-C,C-O, C-S,C-N за счёт энергии разрыва форсофороэфирных связей АТР.
16. Общие свойства ферментов: каталитическая способность, условия максимального проявления каталитического действия. Применение ферментов.
1)смотри вопрос 14
2)применение ферментов
Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезаминирование, декарбоксилирование, дегидратация,конденсация, а также для разделения и выделения изомеров аминокислот L-ряда (при химическом синтезе образуются рацемические смеси L- и D-изомеров), которые используют в промышленности, сельском хозяйстве, медицине. Овладение тонкими механизмами действия ферментов, несомненно, предоставит неограниченные возможности получения в огромных количествах и с большой скоростью полезных веществ в лабораторных условиях почти со 100% выходом.
17. Ферменты белкового обмена. Условия проявления наибольшей активности ферментов.
1)хрень какая то вылезает,в учебнике тоже нету
2)см. вопрос 14
сам не знаю=) я тоже ленивый=)
18. Нуклеиновые кислоты их состав. Структура ДНК. Принцип комплементарности
нуклеиновые кислоты — биополимеры, а их функция заключается в хранении, реализации и передаче генетической (наследственной) информации в живых организмах.
Существует два типа нуклеиновых кислот — дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Мономерами в нуклеиновых кислотах служат нуклеотиды. Каждый из них содержит азотистое основание, пятиуглеродный сахар (дезоксирибоза — в ДНК, рибоза — в РНК) и остаток фосфорной кислоты.
В ДНК входят четыре вида нуклеотидов, отличающихся по азотистому основанию в их составе, — аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т). В молекуле РНК также имеется 4 вида нуклеотидов с одним из азотистых оснований — аденином, гуанином, цитозином и урацилом (У). Таким образом, ДНК и РНК различаются как по содержанию сахара в нуклеотидах, так и по одному из азотистых оснований (табл. 1).
Таблица 1
 2015-04-30
2015-04-30 977
977








