Фермент липоксигеназа катализирует реакцию:
Ненасыщенная жирная кислота + О2 ® гидропероксид ненасышенной жирной
кислоты
Полагают, что действию фермента подвергаются лишь те полинасыщенные жирные кислоты, которые содержат цис-цис-1,4-пентадиеновую группу, как показано ниже:
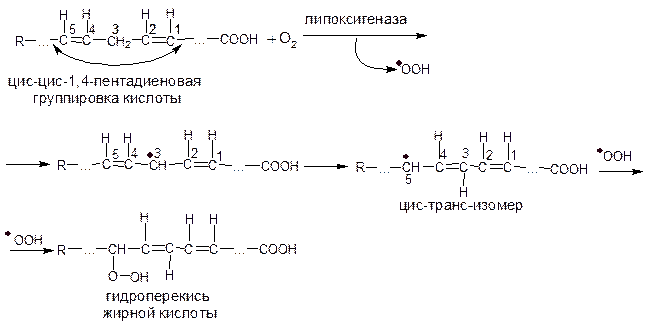
При промежуточном образовании радикалов возникает пероксид; одна двойная связь перемещается в соседнее (коньюгированное) положение, и ненасыщенная жирная кислота переходит в цис-транс-изомер:
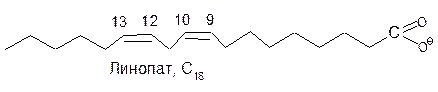
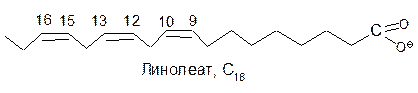
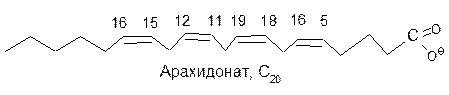
Линолевая, линоленовая и арахидоновая кислоты окисляются ферментом с одинаковой скоростью. Жирные кислоты с транс-конфигурацией двойных связей ферментом не окисляются.
Липоксигеназа широко распространена в растительном мире. Она найдена в пшенице, семенах масличных культур, бобовых, люцерне; особенно велико ее содержание в соевой муке. В результате действия этого фермента происходит прогоркание пищевых продуктов.
Конкурентными ингибиторами фермента являются транс-линолевая и 10, 12-октадекандиеновая кислоты, также (хотя и менее эффективными) ненасыщенные и мононенасыщенные жирные кислоты.
При переработке пищевых продуктов особенно важны ингибиторы липоксигеназы, которые взаимодействуют со свободными радикалами, образующимися в качестве промежуточных продуктов, при действии этого фермента на ненасыщенные жирные кислоты, обрывают цепь превращений благодаря этому прекращают процесс окисления. Таким ингибитором является широко используемый в качестве антиоксиданта токоферол – витамин Е. Фермент можно инактивировать также термической обработкой продукта.
Препараты липоксигеназы находят ограниченное применение при выпечке белого хлеба. Во время замеса теста фермент выполняет различные функции, в результате чего улучшается цвет мякиша и увеличивается объем хлеба.
Активность липоксигеназы определяют с помощью полярографического или монометрического метода по измерению поглощения кислорода.
Принцип метода основан на измерении поглощения кислорода реакционной смесью. Максимум действия липоксигеназы злаков находится при рН 7, а липоксигеназы сои – при рН 9.
Техника определения: отвешивают 2-3 г материала и растирают с фосфатным буфером (рН 6,8) в соотношении 1:5 или 1:10. Затем в основную часть сосуда Варбурга (рис. 6) приливают 2 см3 опытной пробы (гомогената), а в боковую его часть наливают 1 см3 суспензии натриевой соли линолевой кислоты, которую готовят перед употреблением. Для этого энергично встряхивают 0,20 см3 линоленовой кислоты с 5,8 см3 0,1 н. раствора КОН, 20 см3 фосфатного буфера с рН 6,3 и 34 см3 Н2О.
В 1 см3 такового субстрата содержится 3,3 мг линоленовой кислоты рН 7. Далее в центральную часть прибора приливают 0,3 см3 20 %-го раствора КОН для улавливания углекислоты. Объем жидкости в основном сосудике доводят водой до 5 см3. После этого сосуды соединяют с манометром и выдерживают на водяной бане аппарата 20 мин, до выравнивания температуры. Закрыв, верхние краны манометров и наклонив их, переливают в основную часть сосуда и затем включают качание на определенный срок. Одновременно устанавливают контрольные приборчики с манометрами, причем вместо субстрата в боковую часть сосуда наливают 1 см3 воды; в остальном поступают, так же, как и с опытным.
Показания манометров снимают через определенное число минут (5-10). Активность фермента выражают в кубических сантиметрах поглощенного кислорода на 100 мг белка или на 1 г сухой массы за условный промежуток времени.
Для вычисления объема газа, выделившегося при реакции, надо знать константу К каждого сосуда. Точную вместимость сосудов узнают по массе объема ртути (или воды), пошедшей на заполнение сосудов, и по объему манометра до нулевой точки. Зная объем 1 г ртути при определенной температуре, вычисляют исходящую вместимость сосуда. Константу К сосудов вычисляют по формуле:
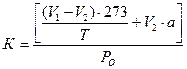 ,
,
где V1 – общая исходная вместимость реакционного сосуда и капиллярной трубки до нулевой точки, см3;
V2 – объем взятой жидкости в сосудик, см3;
Т – температура термостатной бани (если температура отрегулирована на 25 0С, то Т= 273 + 25 = 298;
а – растворимость газов (см3) в 1 см3 воды (растворимость кислорода) при 250С равна 0,028, углекислоты – 0,759;
Р0 – давление, равное 10000 мм столба жидкости Броди.
Материалы, реактивы и оборудование: линолевая кислота (удобно получить из подсолнечного масла) или масло; 20 %-й раствор КОН; фосфатный буфер с рН 6,8; аппарат Варбурга.
 2015-04-30
2015-04-30 1628
1628








