Как и углеводы, липиды поступают в организм с кормом животного и растительного происхождения. Вместе с жирами в организм с пищей поступают жирорастворимые витамины, незаменимые жирные кислоты. Потребность в пищевых жирах для человека составляет 50 – 60 г в сутки.
Поступающие с кормом липиды в ротовой полости не подвергаются специфическим воздействиям, т.к. слюна животных не содержит липолитических ферментов.
В желудке в составе желудочного сока содержится липаза. Однако роль ее в переваривании липидов невелика, т.к. в кислой среде (рН – 2) фермент мало активен, а липиды, будучи гидрофобными имеют малую поверхность контакта. Активность желудочной липазы проявляется у новорожденных животных. У них кислотность желудочного сока меньше (рН – 5), а липиды молока высоко эмульгированные, что является важным условием для работы гидролаз.
Основное переваривание липидов происходит в 12-перстной кишке под действием ферментов поджелудочной железы, кишечного сока и желчи.
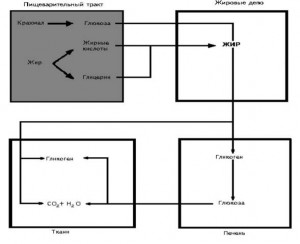
18. Промежуточный обмен липидов происходит в печени, жировой ткани и клетках различных органов, причем он тесно связан с углеводным обменом. При нормальном питании в организме депонируется от 10 до 20 % жира в качестве резервуара энергии и структурного компонента тела.
Жировая ткань — это не просто депо жира, в ней постоянно происходят интенсивные процессы обмена в виде отложения жира в форме триглицерида (липогенез) и распада триглицеридов с освобождением неэтерифицированных жирных кислот (липолиз).
Располагаясь вокруг кровеносных сосудов и пропуская через себя вещества, с избытком поступающие из пищеварительного тракта и легко диффундирующие из сосудов, жировая ткань поглощает труднохранимые и высокогидрируемые соединения (ацетат, бета-окси-бутират), превращая их в легкохранимые и почти безводные жирные кислоты и триглицериды.
Они могут храниться неограниченное время и в неограниченном количестве, а при необходимости использоваться как резервная энергия. Объем жировой ткани определяется не количеством клеток, а их размерами. В зависимости от наполненности жиром различают веретенообразные клетки, не содержащие жира, и мелковакуолистые, наполненные жиром, — адипоциты.
Капли триглицерида в цитоплазме адипоцита могут быть весьма большого размера, вплоть до того, что жир оттесняет цитоплазматические структуры на периферию и клетка приобретает «перстневидную» форму. Освобождение жирных кислот и их окисление используются организмом для покрытия энергетических расходов. В печени образуются и кетоновые тела (ацетоуксусная и Р-оксимасляная кислоты, ацетон), служащие источником энергии, но при нарушении межуточного обмена липидов возможно повышение уровня кетоновых тел (гиперкетонемия) и выделение их с мочой (кетонурия).
19. Пищеварительный этап начинается уже в желудке: воздействие липаз на эмульгированный жир (липиды молока). Основные пищеварительные процессы, обеспечивающие использование пищевых жиров, осуществляются в тонком кишечнике. Под влиянием желчных кислот происходит эмульгирование, благодаря этому они становятся доступны липазам.
В результате ферментативного расщепления триглицериды корма распадаются на глицерин и жирные кислоты. Желчные кислоты, образуя с жирными кислотами водорастворимые комплексы (холеинаты), делают возможным проникновение последних в клетки кишечного эпителия, где могут ресинтезироваться триглицериды или образовываться фосфолипиды.
20. звестно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов и фосфолипидов, так как свободные жирные кислоты присутствуют в тканях и плазме крови в небольших количествах и в норме не накапливаются.
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование а-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения.
В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гли-колитического распада глюкозы образуется дигидроксиацетонфосфат (см. главу 10). Последний в присутствии цитоплазматической глицерол-3-фос-фатдегидрогеназы способен превращаться в глицерол-3-фосфат:
Отмечено, что если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата.
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т. е. «активными» формами жирной кислоты—ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
Как отмечалось, ацилирование глицерол-3-фосфата протекает последовательно, т. е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3-фосфата).
Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:
Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из Р-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых
Жиров. На рис. 11.6 представлены глицерофосфатный, дигидроксиацетон-фосфатный и Р-моноглицеридный (моноацилглицероловый) пути синтеза триглицеридов.
Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,— в митохондриях.
21. Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы.
Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина) дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
Биологическое значение белков чрезвычайно велико. Упомянем только важнейшие функции белков в живых организмах.
1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой. Все известные ферменты представляют собой белковые молекулы. Белки — это очень мощные и, самое главное, селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой единственный фермент.
2. Некоторые белки выполняют транспортные функции и переносят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасает кислород в мышцах.
3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
4. Белки играют важную роль в иммунной системе организма.
Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты - вирусы, бактерии, чужие клетки.
5. Белки-рецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Из приведенного перечня функций белков ясно, что белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называются незаменимыми. Для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин.
22. На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Поэтому об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота,поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины).
Азотистый баланс - схема.
У взрослого здорового человека при нормальном питании имеет место азотистое равновесие, т. е. количество выделяемого азота равно количеству поступающего. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положительный азотистый баланс. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс.
При положительном азотистом балансе часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. Наоборот, при отрицательном азотистом балансе общая масса белков уменьшается (катаболическое состояние).
Если из диеты исключить все белки, но полностью сохранить другие компоненты в количествах, обеспечивающих энергетические потребности организма, то азотистый баланс становится отрицательным. Примерно через неделю пребывания на такой диете количество выводимого азота стабилизируется, достигая величины около 4 г за сутки. Такое количество азота соответствует 25 г белка (или аминокислот). Следовательно, при белковом голодании организм ежесуточно расходует около 25 г белков собственных тканей. Практически такой же результат получается при исключении из диеты не всех белков, а только незаменимых аминокислот или даже только одной из них.
При полном голодании отрицательный азотистый баланс еще больше, чем при исключении из пищи только белков. Это обусловлено тем, что аминокислоты, образующиеся при распаде тканевых белков, при полном голодании используются также и для обеспечения энергетических потребностей организма.
В рационе, достаточном по калорийности, минимальное количество белков, необходимое для поддержания азотистого равновесия, составляет 30-50 г. Однако это количество не обеспечивает оптимума для здоровья и работоспособности. Взрослый человек при средней физической нагрузке должен получать около 100 г белков в сутки.
23. Содержание темы:
1. Организм человека располагает незначительными резервами белков (белки плазмы крови, печени и мышц), тканевые белки имеют период полураспада от
нескольких минут до нескольких месяцев, поэтому он должен постоянно
пополняться белками, особенно >кивотного происхождения, которые содержат
сбалансированный набор незаменимых аминокислот.
2. Все белки тела подвергаются постоянному распаду и синтезу, т.е. находятся в
динамическом равновесии. Точным критерием состояния обмена белков
является азотистый баланс. У здорового человека он равен нулю, т.е. азот,
содержащийся в белках, принимаемым с пищей (N белка ~ 100г/сутки) равен
содержанию азота в азотсодержащих веществах, выводимых в виде конечных
продуктов обмена из организма. При патологиях (голоде, болезни) он
становится отрицательным, при росте или реабилитации больного - он
положителен.
3. При отсутствии белка в пище человек теряет ~ 25 г белка (азота - 4г). Это-
коэффициент изнашивания. Белковое голодание приводит к 1) голодным
отекам (использовании альбуминов плазмы крови в роли источников
аминокислот), 2) анемии (нехватка аминокислот для синтеза гемоглобина), 3)
жировое перерождение печени (недостаточный синтез апо-белков для
транспортных форм липидов, образованных в печени), 4 - плохое
переваривание пищи (недостаточный синтез протеолитических ферментов).
4. Переваривание или гидролиз пептидных связей белка во первых идет в
желудке (13 ротовой полости белки подвергаются только механической
деструкции и набуханию) под действием пепсина, который образуется из
пепсиногена под действием соляной кислоты.
5. Соляная кислота образуется в результате гормональной регуляции (гастрин,
гистамин) из протонов, образующихся при диссоциации угольной кислоты и
ионов хлора, поступающих из плазмы в обмен на гидрокарбонатныий ион угольной кислоты.
6. Роль соляной кислоты: а) вызывает частичный протеолиз неактивного
пепсиногена в активный пепсин; б) денатурирует поступающие белки,
отщепляя небелковые компоненты; в) создает кислотность (- 0,5% Раствор) прикоторой достигается максимальная активность пепсина; г) проявляет
антибактериальную активность.
7. Определение кислотности желудочного сока (N свободной 20-40 ммоль/л;
связанной 10-20 ммоль/л; общей 40-60 ммоль/л) и патологических
компонентов молочной кислоты и крови имеет клинико-диагностическое
значение для определения разных видов гастрита, язвы или даже рака желудка.
8. Пепсин - эндопептидаза, катализирующая гидролиз пептидных связей перед
ароматическими и дикарбоновыми аминокислотами. Образовавшиеся крупные
пентоны поступают с пищевым комком в двенадцатиперстную кишку, где под
действием секретина создается щелочная среда (за счет гидрокарбонатов
плазмы).
9. У детей грудного возраста соляной кислоты недостаточно и в желудке
имеется ренин, вызывающий частичный гидролиз казеина, в результате
образуется нерастворимый сгусток, задерживающий выход молока из желудка
и его переваривание.
10. Панкреас синтезирует трипсиноген, химотрипсин, проэластазу,
прокарбоксипептидазу, которые переходят в активные формы, образуя трипсин
(частичный протеолиз под действием гормона местного действия
энтеропептидазы), он в свою очередь активирует остальные ферменты.
11. Трипсин гидролизует пептидные связи после диаминокислот, химотрипсин
- после ароматических аминокислот, карбокиспептидаза отщепляет С -
концевую аминокислоту, эластаза связь ала-гли.
12. В тонком кишечнике под действием ферментов пристеночного пищеварения
- аминопептидазы и дипептидаз, отщепляются аминокислоты с N-конца и под
действием дипептидаз образуются свободные аминокислоты.
13. Аминокислоты проходят через клеточные мембраны соответствующими
белками - переносчиками (в почках) вторично - активным транспортом с Na+
(в воротную вену), у - глутаминным циклом из крови в клетки для
внутриклеточного использования.
25. Это комплекс превращений отдельных аминокислот в реакциях пере-, дезаминирования, амидирования, декарбоксилирования, трансметилирования и др. Для белкового обмена пере- и дезаминирование имеют универсальное значение.Переаминирование дает: 1) образование новых молекул аминокислот; 2) устанавливает связь белкового и углеводного обменов; 3)осуществляется введение азота в пиримидиновые и пуриновые основания; 4) образование аминосахаров, порфиринов и креатина; 5) дезаминирование аминокислот происходит при участии реакции переаминирования.
Переаминирование происходит между амино- и
кетокислотами под влиянием трансминаз, активной группой которых является витамин Вб (фосфопиридоксаль). Направление реакции переаминирования зависит от соотношения субстратов, участвующих в переаминировании. Реакции переаминирования зависят от активности трансаминаз (при белковом голоданиисинтез трансаминаз нарушается, в ряде случаев нарушается гормональная регуляция активности ферментов). Гормоны могут изменять активность трансаминаз в различных органах по-разному.
Для некоторых аминокислот реакция переаминирования является первой в цепи последовательных превращений и нарушение ее меняет весь ход обмена данной аминокислоты (например, нарушение переаминирования тирозина сопровождается декарбоксилированием его). Показано, что глюкокортикоиды стимулируют переаминирование тирозина, а гормоны щитовидной железы тормозят. Локальное нарушение процессов переаминирования в отдельных органах и тканях
возникают при развитии в них некрозов с поступлением в кровь тканевых трансаминаз (инфаркт, гепатиты и др.).
Дезаминирование - определяет образование конечных продуктов белкового обмена и вступление аминокислот в энергетический обмен. При голодании, особенно углеводном, процессы дезаминирования усиливаются и энергетические потребности организма покрываются за счет белка. Ослабление дезаминирования может возникнуть вследствие нарушения окислительных процессов в тканях (гипоксия), гиповитаминозах (С, РР, В2), понижении активности аминооксидаз вследствиеослабления их синтеза (поражение печени или белковое голодание). Следствием нарушения дезаминирования аминокислот будет ослабление мочевинообразования,увеличение концентрации аминокислот в крови, увеличение выведения их с мочой - аминоацидурия, то есть нарушение конечного этапа белкового обмена. Межуточный обмен некоторых аминокислот (гистидин, глютаминовая кислота, тирозин) совершается декарбоксилированием в комплексе с коферментом фосфопиридоксалем. При этом образуются амины (гистамин, тирамин, серотонин, окситриптамин, у -аминомасляная кислота) - биологически активные вещества. Однако, в норме декарбоксилирование этих аминокислот не является основным путем их превращения, а образующиеся в малых количествах амины связываются белками с помощьюсоответствующих оксидаз и подвергаются окислению с образованием альдегидов и свободного аммиака. При усилении активности декарбоксилаз или при нарушении связывания аминов белками, или вследствие торможения оксидаз, в тканях и крови накапливаются амины, которые могут реализовать свой токсический эффект. Установлено, что гипоксия и деструкция тканей способствует накоплению этих аминов с патогенным действием на органы и системы. Нарушение другихиндивидуальных путей межуточного обмена отдельных аминокислот: тирозина, фенилалинина, триптофана, цистеина и метионина имеет иные своеобразные проявления. Так, развивается фенилпировиноградная олигофрения из-за отсутствия или недостатка фермента фенилаланингидроксилазы и т.п.
Аминоацидурия наблюдается при травме, распаде тканевых белков, кахексии, поражении печень (нарушается дезаминирование и мочевинообразование), при нарушении реабсорбции аминокислот в почках.
Таким образом, в основе нарушения межуточного обмена аминокислот лежит патология ферментативных систем, определяющих ход тех или иных обменных реакций. Патология ферментативных систем может возникать вследствие врожденнойаномалии их синтеза, нарушения синтеза белковых структур ферментов при общей белковой недостаточности или дистрофических процессах в тех или иных органах. Другими причинами нарушения ферментативной активности являютсянедостаточность тех или иных витаминов, участвующих в катализе обменных реакций, а также изменений оптимальных условий действия ферментов (гипоксия, сдвиги рН и т.д.). Патофизиологическое значение нарушений межуточного звена в обмене белков; 1) могут возникать продукты токсического характера; 2) нарушение скорости превращения и выделения отдельных аминокислот будет нарушать количественноесоотношение между ними. И то и другое, в конечном итоге, приводит к нарушению синтеза белка в организме, нарушению образования и экскреции конечных продуктов белкового обмена.
26. Орнитиновый цикл, цикл Кребса-Хензелейта, цикл мочевины (ornith cycle, Krebs-Henseleit cycle, urea cycle) [греч. ornithos — птица и лат. -in(e) — суффикс, обозначающий «подобный»; греч. kykios — круг, цикл] — циклическая последовательность ферментативных реакций, в результате которых происходит ассимиляция NH3 (в виде NH4+) и синтез мочевины. О.ц. протекает у позвоночных в печени с использованием углерода в виде CO2 и азота в виде аммиака и аминогруппы аспарагиновой кислоты (см. Аспарагиновая кислота). Первоначально в результате реакции между СО2 и аммиаком образуется карбамоилфосфат, который вступает в реакцию с орнитином (см. Орнитин). Образуемый при этом цитруллин (см. Цитруллин), взаимодействуя с аспарагиновой кислотой, превращается в аргининоянтарную кислоту, которая расщепляется на аргинин (см. Аргинин) и фумаровую кислоту. Далее фермент аргиназа расщепляет аргинин на мочевину и орнитин. Благодаря О.ц. организм освобождается от токсичного для него аммиака и обеспечивает синтез экскреторного продукта азотистого обмена — мочевины. Образующийся при этом оротидин-5'-фосфат (оротидиловая кислота) подвергается декарбоксилированию с образованием уридин-5'-фосфата (урациловой кислоты). Последний превращается в уридинтрифосфат (см. Уридинтрифосфат, УТФ), из которого образуются цитидинтрифосфат (путем замены в УТФ группы ОН в положении 4 на группу NH2) и тимидинтрифосфат (метилированием УТФ в положение 5). Ферменты О.ц. присутствуют также в клетках растений и микроорганизмов, у которых они играют важную роль в связывании солей аммония с образованием органических азотистых соединений. О.ц. впервые описан Г. Кребсом и К. Хензелейтом в 1932 г. (Нобелевская премия за 1953 г.).
27. Аминокислоты полностью распадаются до NН3 СО2, и Н2О. Вода участвует во всех обменных процессах. Углекислый газ входит в состав буферных систем, используется в синтезе жирных кислот, пуриновых и пиримидиновых оснований, углеводов. Избыток выводится с помощью легких. Аммиак является высокотоксичным соединением и поэтому его концентрация в организме должна сохраняться на низком уровне. В крови в норме обнаруживается 25−40 мкмоль/л. При более высоких концентрациях аммиак оказывает токсическое действие, особенно на клетки мозга. Показано, что концентрация аммиака в крови 3 ммоль/л является летальной. Таким образом, аммиак должен подвергаться связыванию в тканях с образованием нетоксичных соединений, легко выделяющихся наружу.
28/ см выше!
В тканях аммиак находится преимущественно в виде иона аммония NН 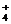 в равновесии с небольшой концентрацией неионизированного аммиака.
в равновесии с небольшой концентрацией неионизированного аммиака.
1. Восстановительное аминирование.
Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах - это биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина):
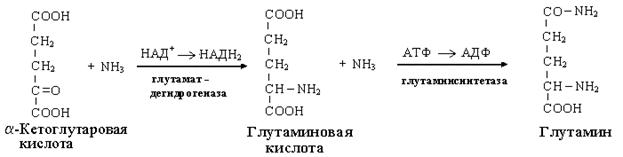
Эта реакция протекает во многих тканях, но наиболее важна для нервной, особенно чувствительной к токсическому действию аммиака. Первая реакция представляет собой обращение глутаматдегидрогеназной реакции (обратная окислительному дезаминированию ГЛУ).
Обезвреживание аммиака путем синтеза глутамина имеет и анаболическое значение, поскольку глутамин используется для синтеза ряда соединений. Прежде всего нужно отметить, что глутамин — одна из 20 аминокислот, входящих в белки. Кроме того, амидная группа глутамина используется для синтеза аспарагина, глюкозамина и других аминосахаров, пуриновых и пиримидиновых нуклеотидов. Таким образом, в этих реакциях азот аммиака включается в разнообразные структурно-функциональные компоненты клетки.
Глутамин затем может поступать во все ткани, где осуществляется его гидролиз при участии глутаминазы:

Подобным образом происходит образование аспарагина (через ЩУК).
2. Образование аммонийных солей.
Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки. Но она в несколько раз повышается при ацидозе, т. е. при увеличении содержания кислот в организме. Аммиак в почках образуется главным образом за счет амидной группы глутамина. Глутамин гидролизуется активируемой фосфатом глутаминазой, имеющейся в клетках эпителия канальцев почки. Часть аммиака (примерно 30%) образуется другим путем — в результате непрямого дезаминирования аминокислот.
Образующийся аммиак нейтрализует кислоты: NH3 + Н+ → NH4+. Неионизированные аммиак и кислоты в клетках находятся в равновесии с их ионизированными формами. Через клеточные мембраны проникают преимущественно неионизированные аммиак и кислоты, и в просвете почечного канальца (т. е. уже в моче) аммиак акцептирует протон кислоты, образуя аммонийную соль, которая выводится из организма. Экскреция аммиака почками служит для выведения именно кислот, а не азота, на что указывает значительная скорость экскреции при ацидозе, малая — при нормальной кислотности межклеточной жидкости и крови, и отсутствие экскреции аммиака при алкалозе. Одновременно этот процесс обеспечивает сохранение организмом ионов Na+, которые в отсутствие ионов аммония выводились бы с анионами кислот. Потеря таких количеств Na+, которые необходимы для выведения кислот при ацидозе, могла бы вызвать снижение осмотического давления межклеточной жидкости и крови, а вследствие этого уменьшение объема межклеточной жидкости, т. е. обезвоживание тканей.
3. Основным механизмом связывания аммиака в организме является синтез мочевины. Мочевина выводится из организма с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного обмена. На долю мочевины приходится до 80-85 % от всего выводимого из организма азота. Количество выделяемой мочевины зависит от количества белков, поступающих с пищей. Если суточный рацион включает 80–100 г белка, то за сутки образуется и выводится 25–30 г мочевины.
Основным местом синтеза мочевины является печень. Синтез мочевины является циклическим метаболическим процессом и носит название орнитинового цикла мочевинообразования Кребса (цикл мочевины Кребса - Хензеляйта).
На первом этапе из NН3 и СО2 при участии АТФ синтезируется макроэргическое соединение карбамоилфосфат:
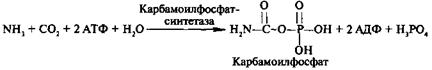
На втором этапе цикла мочевинообразования происходит конденсация карбомоилфосфата и орнитина с образованием цитруллина. На следующей стадии вначале происходит связывание одной молекулы NН3 путем восстановительного аминирования с образованием (с затратой молекулы АТФ) аспарагиновой кислоты. Затем цитруллин и аспарагиновая кислота взаимодействуют с образованием аргининосукцината, который распадается на аргинин и фумарат при участии аргининосукцинатлиазы. Аргинин расщепляется под действием фермента аргиназы на орнитин и мочевину 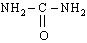 .
.
Образовавшийся орнитин может вступать в следующий цикл мочевинообразования. Хотя аргинин есть во всех клетках организма человека, образование мочевины происходит исключительно в клетках печени - единственном органе, где локализован фермент аргиназа. Мочевина из клеток печени поступает в кровь и выводится из организма через почки.
Для синтеза одной молекулы мочевины требуется две молекулы NН3, одна молекула СО2 и три молекулы АТФ.
Т.о., исходя из фактических данных о механизмах обезвреживания аммиака в организме часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования a-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиак расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных.
29. Биологическая ценность белка.
По современным представлениям под биологической ценностью белков понимают зависящую от их аминокислотного состава и других структурных особенностей степень задержки азота пищи в растущем организме или эффективность его утилизации для поддержания азотистого равновесия у взрослых.
Указанный критерий позволяет установить место пищевых белков по степени сравнительной пользы для организма человека и животных. Биологическая ценность пищевых белков зависит в основном от содержания и соотношения входящих в их состав незаменимых аминокислот.
Белки животного происхождения (говядина, треска), имеют высокую биологическую ценность.
Растительные белки лимитированы по ряду незаменимых аминокислот и прежде всего — по лизину. Второй лимитирующей аминокислотой для белков пшеницы и риса является треонин.
Биологическая ценность белков коровьего молока по сравнению с белками женского молока значительно лимитирована дефицитом серосодержащих аминокислот (метионин + цистин) и триптофана, что свидетельствует о необходимости коррекции его аминокислотного состава при использовании в питании детей раннего возраста.
Биологическая ценность белков коровьего молока по сравнению с белками женского молока значительно лимитирована дефицитом серосодержащих аминокислот (метионин + цистин) и триптофана, что свидетельствует о необходимости коррекции его аминокислотного состава при использовании в питании детей раннего возраста.
Биологическая ценность белков зависит не только от их аминокислотного состава, но и от доступности отдельных аминокислот.
При избыточном нагревании продуктов, богатых углеводами, в них снижается количество доступного лизина вследствие реакции меланоидинообразования.
Важным показателем качества пищевого белка может служить также степень его усвояемости, которая отражает протеолиз в желудочно-кишечном тракте и последующее всасывание аминокислот.
По скорости переваривания протеолитическими ферментами пищевые белки можно расположить в следующей последовательности:
1 — рыбные и молочные;
2 — мясные;
3 — белки хлеба и круп.
Рассмотренные представления о биологической ценности пищевых белков необходимы для правильного использования различных белковых продуктов при построении сбалансированных рационов питания.
Многие растительные продукты, особенно злаковые, содержат белки пониженной биологической ценности: в кукурузе, например, имеется значительный дефицит триптофана и лизина, в пшенице — лизина и треонина.
Продукты животного происхождения содержат сравнительно высокое количество триптофана, лизина и серосодержащих аминокислот. Поэтому для удовлетворения потребностей организма в аминокислотах целесообразно использовать комбинации пищевых продуктов по принципу взаимного дополнения лимитирующих биологическую ценность аминокислот.
Содержание белка в основных пищевых продуктах
Продукт Белок, г/100 г съедобной части -
Говядина 18,6—20,0
Баранина 15,6—19,8
Свинина мясная 14,3
Печень говяжья 17,9
Куры 18,2—21,2
Утки 15,8—17,2
Яйца куриные 12,7
Колбаса любительская
вареная 12,2
Сервелат 24,0
Сардельки свиные 10,1
Судак 18,4
Треска 16,0
Навага 15,1 — 19,2
Икра осетровых (паюсная) 36,0
Молоко коровье пастеризованное 2,79
Творог нежирный 18,0
Сыры (твердые) 19,0—31,0
Соя 34,9
Горох 20,5
Фасоль 21,0
Грибы сушеные (белые) 20,1
Ядро ореха фундук 16,1
Мука пшеничная 1-го сорта 10,6
Мука ржаная сеяная 6,9
Крупа манная 10,3
гречневая ядрица 12,3
рисовая 7,0
Хлеб из муки пшеничной 7,6—8,1
ржаной 4,7—7,0
Макаронные изделия высшего сорта 10,4—11,8
Хлеб безбелковый из пшеничного крахмала 0,7
Диетические безбелковые
макаронные изделия 1,0
Капуста белокочанная 1,8
Морковь 1,3
Свекла 1,5
Томаты 1,1
Картофель 2,0
Апельсины 0,9
Яблоки, груши 0,4
Смородина черная 1,0
Масло сливочное несоленое 0,5
Масло сливочное бутербродное 2,9
Ягоды, фрукты и овощи (за исключением бобов и зеленого горошка, содержащих соответственно 6 % и 5 % белка) включают незначительные количества белка.
 2015-04-30
2015-04-30 1407
1407
