Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
1. Клеточная локализация и функция
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
2. Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
· Гем - молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В теме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe2+, находящимся в центре молекулы (рис. 1-29).
· Апомиоглобин - белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8?-спиралей.?-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву?-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
· Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
3.Связывание гема с апомиоглобтом
Гем - специфический лиганд апомиоглобина, присоединяющийся к белковой части в углублении
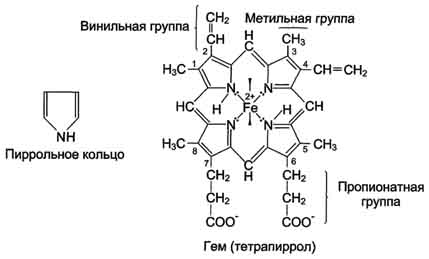
Рис. 1-29. Строение тема, входящего в состав миоглобина и гемоглобина.
между двумя?-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца тема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях рН, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости тема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в теме может образовывать 6 координационных связей, 4 из которых удерживают Fe2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fe2+ и атомом азота имидазольного кольца Гис F8 (рис. 1-30).
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда - О2 к миоглобину.
Аминокислотное окружение тема создаёт условия для довольно прочного, но обратимого связывания О2 с Fe2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe2+ в Fe3+. Трёхвалентное железо в составе тема не способно присоединять О2.
 2015-04-30
2015-04-30 12436
12436








