Впервые А. Я. Данилевский (1881) разделил экстрагируемые из мышц белки на три класса: растворимые в воде, экстрагируемые 8 — 12% раствором хлорида аммония и белки, извлекаемые разбавленными растворами кислот и щелочей. В настоящее время белки мышечной ткани делят на три основные группы: саркоплазматические белки, миофибриллярные белки, белки стромы. На долю первых приходится около 35%, вторых —45% и третьих-20% всего мышечного белка. Эти группы белков резко отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Белки, входящие в состав саркоплазмы, принадлежат к числу протеинов, растворимых в солевых средах с низкой ионной силой.
К числу саркоплазматических белков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обменов. Недавно была открыта группа саркоплазматических белков — парвальбумины, которые способны связывать ионы кальция.
К группе миофибриллярных белков относятся миозин, актин и актомиозин — белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
|
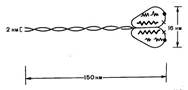
Миозин составляет 50-55% от сухой массы миофибрилл. Миозин обладает АТФазной активностью, т. е. способностью катализировать расщепление АТФ на АДФ и Н3РО4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи и несколько коротких легких цепей. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головку» молекулы), способную соединяться с актином. Эти головки выдаются из основного стержня молекулы.
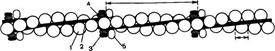
 Толстые нити (толстые миофиламенты) в саркомере получены путем соединения большого ппчисла определенным образом ориентированных в ппппппппппппппппппппппппппппппппппппространстве молекул миозина.
Толстые нити (толстые миофиламенты) в саркомере получены путем соединения большого ппчисла определенным образом ориентированных в ппппппппппппппппппппппппппппппппппппространстве молекул миозина.
Актин, составляющий ~20% от сухой массы миофибрилл. Известны две формы актина: глобулярный (Г-актин) и фибриллярный (Ф-актин) актин. Молекула Г-актина состоит из одной полипептидной цепочки, в образовании которой принимают участие 374 аминокислотных остатка. Ф-актин является продуктом полимеризации Г-актина и имеет структуру двухцепочечной спирали.
Актомиозин образуется при соединении миозина с Ф-актином. Актомиозин, как обладает АТФазной активностью. Однако АТФазная активность актомиозина отличается от АТФазной активности миозина. Фермент актомиозин активируется ионами магния и ингибируется этилен-диаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2 +, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня. На долю тропомиозина приходится около 4 — 7% всех белков миофибрилл.

 Тропонин — глобулярный белок, открытый С. Эбаси в 1963 г. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, Тн-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция.
Тропонин — глобулярный белок, открытый С. Эбаси в 1963 г. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, Тн-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция.
Белки стромы в поперечнополосатой мускулатуре представлены в основном коллагеном и эластином.
 2015-04-30
2015-04-30 1272
1272
