Миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция. Наибольшая сократительная активность наблюдается при концентрации ионов кальция около 10-6 —10-5 М.
В покоящейся мышце (миофибриллах и межфибриллярном пространстве) концентрация ионов кальция поддерживается ниже этой пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур.
Связывание ионов кальция разветвленной сетью трубочек и цистерн саркоплазматической сети - это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой АТФазой саркоплазматической сети. Таким образом, скорость выкачивания ионов кальция из межфибриллярного пространства стимулируется ионами кальция. В целом этот механизм получил название «кальциевой помпы».
Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т-системы некоторого количества ионов кальция в саркоплазму.
«Чувствительность» актомиозиновой системы к ионам кальция (т. е. потеря актомиозином способности расщеплять АТФ и сокращаться в присутствии АТФ при снижении концентрации ионов кальция до 10 -7 М) обусловлена присутствием в контрактильной системе (на нитях Ф-актина) белка тропонина, связанного с тропомиозином. В тропонин-тропомиозиновом комплексе ионы кальция связываются именно с тропонином. При этом в молекуле тропонина происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тропомиозинового стержня и деблокировке активных центров актина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Мg2+-АТФазы.
|
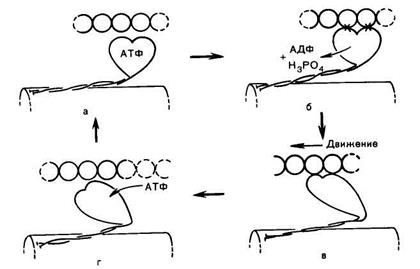
В продвижении актиновых нитей вдоль миозиновых, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул.
Когда мышца находится в состоянии покоя, головки миозина содержат АТФ. После поступления в мышцу нервного импульса по саркоплазматической сети проходит волна возбуждения; ионы Са2 + освобождаются и в это время срабатывает мостиковый механизм, миозиновая головка присоединяется к соответствующему центру активной нити (нити Ф-актина) под углом 90°. Это происходит за счет энергии АТФ. Затем наступает спонтанный поворот головки на 45°, развивается натяжение и происходит продвижение актиновой нити на один элементарный шаг (~ 11 нм).
Далее в результате присоединения новой порции АТФ к поперечному мостику наблюдается диссоциация актомиозина на миозин и актин, т. е. разъединение миозиновых и актиновых нитей, и одновременно начинается новый акт зарядки (фосфорилирования) свободного миозина путем взаимодействия его с АТФ в присутствии ионов Mg2+. По-видимому, чем большее число мостиков прикреплено в данный момент к актиновым нитям, тем больше сила мышечного
сокращения.
Если возбуждение прекращается, содержание ионов кальция в саркоплазме снижается, то циклы прикрепление - освобождение прекращаются, т. е. головки миозиновых нитей перестают прикрепляться к актиновым нитям. При этом в присутствии АТФ мышца расслабляется и ее длина достигает исходной. Если же прекращается поступление АТФ (аноксия, отравление дыхательными ядами или смерть), то мышца переходит в состояние окоченения. Почти все поперечные мостики миозиновых нитей присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы.
 2015-04-30
2015-04-30 451
451







