Материалом для исследований явилась сыворотка крови беременных женщин контрольной группы и беременных женщин с гипотиреозом при сроке 36-39 недель в возрасте 20-35 лет.
Для модельных экспериментов использовались половозрелые лабораторные крысы массой 200-250 гр. с 21-22 дневным циклом гестации.
Была разработана модель экспериментального гипотиреоза на лабораторных крысах путем перорального введения меркозолила в дозе 3 мг/кг массы тела на протяжении всего срока беременности. Для фиксирования гипотиреоза были проведены предварительные замеры содержания гормонов щитовидной железы в периферической крови крыс.
В качестве немедикаментозной фитотерапии применяли бальзам «Возрождение» и экстракт «Золотой корень» из расчета 0,1 мл/кг веса.
Для выделения фракции эритроцитов кровь центрифугировали 10 мин при 1000 g. Плазму и лейкоциты удаляли, а эритроциты дважды промывали средой инкубации, содержащей 150 мМ NaCl, 5 мM Na2HPO4 (рН – 7,4). Плазму замораживали и хранили при -20о С для дальнейших анализов (рисунок 5).

Рисунок 5. Подготовка проб крови к анализу
Осмотическую резистентность эритроцитов определяли по степени гемолиза в растворах NaCl различной концентрации (0,35- 0,9 г/100мл) при режиме инкубации 20 мин при 370С. Уровень гемолиза клеток рассчитывали в процентах по отношению к 100% гемолизу, вызванному 0,1 г/100мл раствором Na2CO3.
Проницаемость эритроцитарных мембран (ПЭМ) для анионов определяли по методу Колмакова и др. [43].
Принцип метода определения ПЭМ - гемолиз в смесях изотонических растворов мочевины и хлористого натрия. Использовались рабочие смеси изотонических растворов мочевины (18 г/л) и хлористого натрия (8,5 г/л) в следующих объемных соотношениях: 40:60, 45:55, 50:50, 55:45, 60:40 и 65:35. В последней пробирке содержится изотонический раствор мочевины, служащий эталоном 100% гемолиза, с которым сравнивают все остальные пробы. Через 2-3 мин пробы осторожно перемешивают, центрифугируют 10 мин при 1000 g и определяют плотность надосадочной жидкости фотометрированием (рисунок 6).

Рисунок 6. Спектрофотометр
Перекисную резистентность эритроцитов изучали по методу [44] в модификации Мурзахметовой и др. [45].
Сахарозное сжатие эритроцитов проводили по методике, основанной на определении степени гемолиза в растворах сахарозы различной концентрации. Клетки крови подвергали гиперосмотическому сжатию в 2 мл 0,2 -0,5М растворах сахарозы при инкубации проб в течение 60 мин при 370С. Далее эритроциты центрифугировали 20 мин при 1000 g, затем в супернатанте определяли оптическую плотность при λ = 540 нм.[46].
Гиперосмотический шок эритроцитов проводили путем инкубации эритроцитов в 4М растворе NaCl в течение 5 мин при 370С. Далее пробы подвергались центрифугированию в течение 10 мин при 1000 g и степень гемолиза определяли по оптической плотности супернатанта [46].
Активность каталазы мембран эритроцитов определяли по методу[47].
Во всех методиках после инкубации эритроцитов в соответствующих средах фракцию эритроцитов центрифугировали 10-20 мин при 1000g. Оптическую плотность определяли спектрофотометрически (рисунок 6) в супернатанте при λ = 540 нм и степень гемолиза (А) рассчитывали по формуле:
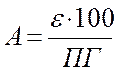
где ε – экстинция опытной пробы, ПГ – экстинция пробы при полном гемолизе.
Характеристика использованных реактивов. В работе использовалиреактивы фирмы «Алтей», «Реахим» (Россия), «Reanal» (Венгрия) квалификации «х.ч.», «ос.ч.».
Статистическая обработка данных. Полученные результаты статистически обрабатывали с использованием программы Microsoft Excel. С учетом критерия Фишера-Стьюдента зарегистрированные изменения показателей считали достоверными при р ≤ 0,05.
 2015-05-14
2015-05-14 786
786








