Надежность и стабильность функционирования биологических систем в экстремальных условиях внешней среды зависят от резистентности целостного организма к стрессовым воздействиям.
Сохранение в изменяющихся условиях среды оптимального уровня поддержания гомеостаза свидетельствует о полноценной работе механизмов, направленных на развитие адекватной адаптационной реакции организма. При нарушении гармоничных взаимоотношений между организмом и окружающей средой в организме возникают различной степени отклонения в формировании процессов адаптации [18].
Резистентность определяется, как способность сохранять в организме и его системах оптимальный режим жизнедеятельности. Между резистентностью и реактивностью организма прослеживается тесная взаимосвязь. Реактивность может в разной степени обусловливать формирование устойчивых состояний организма и его систем и зависит от степени резистентности [19].
Повреждение клеток является определяющим моментом в возникновении, как морфологических нарушений, так и функциональных. Любая клетка обладает различными механизмами, обеспечивающими клеточную резистентность, которые тесно взаимосвязаны с общей резистентностью организма [20].
|
|
|
В повышении резистентности клеток принимают участие органоиды, компоненты мембран, сульфгидрильные группы белковых молекул, специальные ферментные системы и другие составляющие, изменение характеристик которых является критерием уровня резистентности определенного типа клеток и организма в целом.
Модификация клеточных мембран наблюдается в клетках при изменении их физиологического состояния, вызванного факторами окружающей среды [21]. Ведущая роль в изменении структурно-функциональной целостности клеток принадлежит дестабилизации и деформации клеточных мембран. В большинстве случаев причиной нарушения функции мембран является действие свободных радикалов, которые появляются в результате усиления окислительных процессов [22].
При рассмотрении механизмов резистентности одним из узловых вопросов является изучение неспецифических клеточных механизмов защиты. Деятельность функциональных систем организма строится на основе процесса саморегуляции.
Ведущими факторами, обеспечивающих нормальное течение обмена веществ и осуществление важнейших физиологических функций организма, являются процессы перекисного окисления липидов, тканевого дыхания, содержание и состав клеток крови, субстанциональное состояние клеток и тканей живого организма. Процессы биологического окисления занимают центральное место в метаболизме клеток. Они служат источником главной массы энергии, необходимой для жизнедеятельности организма, готовят пластический материал для создания и обновления клеточных структур, принимают непосредственное участие в самом построении структур, включают широкий круг реакций, связанных с метаболическими превращениями углеводов, липидов, белков, чужеродных и прочих соединений.
|
|
|
В процессах биологического окисления особое место занимает кислород. Радикалы кислорода вызывают окисление биомакромолекул, а также инициируют цепные процессы ПОЛ в мембранах вызывая прямое окислительное повреждение нуклеиновых кислот и белков [23].
Все многообразие процессов, протекающих с участием кислорода можно, исходя из соответствующих структурных, функциональных и химических признаков, свести к нескольким основным типам:
1. Оксидазные реакции, катализируемые ферментами, расположенными, в основном, во внутренней мембране митохондрий.
2. Реакции оксигеназного типа, связанные с электроннотранспортнойсистемой эндоплазматического ретикулума и использующие кислород с пластическими целями. Эти реакции предполагают включение одного или двух атомов кислорода в молекулу субстрата.
3. В реакциях митохондриального и микросомального окисления, в результате неполного восстановления кислорода до воды, образуются его активные формы – супероксидный анион-радикал, гидроксильный радикал, синглентный кислород, перекись водорода. Эти активные формы кислорода, реагируя с эндогенными субстратами и, прежде всего, с ненасыщенными жирными кислотами, образуют так называемые перекисные соединения. Поэтому этот процесс, имеющий свободнорадикальный характер, получил название перекисного окисления липидов (ПОЛ).
В живых тканях возможны два вида перекисного окисления: ферментативное и неферментативное. Первое структурно локализовано в клетке и составляет этап образования биологически активных веществ, оно регулируется нейроэндокринной системой.
Для патологических процессов особый интерес представляет неферментативное свободнорадикальное окисление, что связано с рядом отличий его от энзимных окислительных процессов, определяющих его разрушительный характер.
Субстратом неферментативного аутоокисления могут служить не только жирные кислоты и моносахариды (как для биологического окисления), но и сложные молекулы липидов, полисахаридов, белков и нуклеиновых кислот.
Перекисное окисление липидов известный образец окислительного повреждения клеточных мембран, липопротеинов и других липидсодержащих структур. Перекисная модификация ненасыщенных фосфолипидов, гликолипидов и холестерина может происходить в реакциях, вызванных во-первых, формами свободных радикалов типа кислородных радикалов, перекисных радикалов и гидроксильных радикалов, полученных с участием ионов металлов переменной валентности из пероксида водорода или во-вторых, нерадикальными формами типа синглетного кислорода, озона, и пероксинитрита, образованного реакцией супероксида с нитроксидом. Поскольку промежуточным продуктом разветвленных цепных реакций являются перекиси и скорость данных реакций зависит от концентраций перекисных радикалов, которые становятся источником новых цепей, то весь этот процесс был назван перекисным окислением.
ПОЛ в физиологических условиях является естественным процессом, который участвует в обновлении состава и свойств биологических мембран в энергетических, пластических процессах жизнедеятельности клетки [24].
В процессе жизнедеятельности в тканях организма непрерывно происходит образование свободных радикалов и перекисных соединений органической и неорганической природы, участвующих в биохимических реакциях. Высокие концентрации свободных радикалов и радикальные производные, а также нерадикальные реактивные формы кислорода повреждают все основные клеточные компоненты и представляют опасность для живых организмов. Умеренные концентрации нитроксида (NO), супероксидного аниона и других реактивных форм кислорода играют важную роль как регуляторные посредники в сигнальных процессах. Основным субстратом свободнорадикальных реакций (СРО) служат ненасыщенные липиды. Благодаря ненасыщенности углеводородной цепи жирных кислот и непрочности связи аллильных атомов водорода с метиленовыми группами, фосфолипиды клеточных мембран наиболее предрасположены к реакции окисления, инициируемой свободными радикалами, образующимися в клетке. Этому способствует и то обстоятельство, что молекулярный кислород в 7 - 8 раз лучше растворяется в липидной фазе, чем в воде и гидрофильных участках клетки. Существенная активация процесса образования свободных радикалов при химических воздействиях приводит к усилению перекисного окисления липидов и повреждению биологических мембран. Процесс перекисного окисления усиливается вторичным образованием из липидов высоко реакционно-способных и легко диффундирующих карбонильных радикалов, которые могут обусловливать неблагоприятные процессы, развивающиеся в клетках далеко за пределами места своего образования не только клетки, но и органа [25]. Следствием цепной реакции является возрастание продуктов перекисного окисления липидов, которые способны вызывать окисление различных биосубстратов и тем самым повреждать белки и липиды биомембран, инактивировать ферменты, изменять структуру макромолекул, целостность клетки и внутриклеточных органелл. Поэтому необходимым условием функционирования клетки является поддержание нормального уровня процессов СРО. При действии на организм человека и животных различных неблагоприятных факторов химической и физической природы, а также в стрессорных ситуациях процессы СРО приобретают ярко выраженный характер.
|
|
|
По всей видимости, активацию ПОЛ можно рассматривать как неспецифический компонент реакции организма на стрессовые воздействия, поскольку понятие стресса включает в себя «общую неспецифическую нейрогуморальную реакцию, возникающую в организме в условиях, угрожающих нарушением гомеостаза». Работы многих авторов свидетельствуют о том, что нарушение процессов свободнорадикального окисления может приводить к развитию различных патологических ситуаций [26]. Установлено, что накопление в мембранах продуктов окисления липидов меняет структуру мембран и вызывает изменение их функциональной активности.
|
|
|
При возникновении патологических состояний баланс между процессами образования и расходования перекисей в тканях нарушается и происходит накопление продуктов ПОЛ, приводящее к серьезным нарушениям в биомембранах. При критическом уровне накопления продуктов ПОЛ в организме развивается синдром липидной пероксидации, приводящий к повреждению мембранных липидов, липопротеидов и белков, инактивации ферментов, нарушению клеточного деления и фагоцитоза, в результате чего происходит изменение структурно-функциональной организации мембран, формированию патологических состояний воспалении, дистрофии, функциональным нарушениям. Структурная перестройка поверхности мембраны служит начальным звеном в сложной цепи событий, приводящих клетку в новое функциональное состояние, при этом происходит прямая конформационная перестройка биополимеров, структура которых зависит от состояния мембраны.
Система свободнорадикального перекисного окисления является универсальным механизмом контроля гомеостатических физико-химических параметров клетки.
Ряд авторов сходится во мнении, что повреждение мембран является результатом активации трех основных процессов. К ним относится, во-первых, действие фосфолипаз и липаз. Во-вторых, встраивание в липидный бислой экзогенных жирных кислот и лизофосфатидов, что может привести к угнетению функции транспортных белков, являющихся «мембранными насосами» клеток и как следствие, к изменению потока ионов. И наконец, активация процесса ПОЛ является третьим повреждающим мембраны фактором. Активация ПОЛ приводит к изменению свойства липидов мембран, что с неизбежностью отражается на функциональном состоянии мембран, ее «текучести», делает липидную фазу мембран более ригидной, ПОЛ в данном случае выступает в роли важного фактора обновления свойств липидов мембран, модификации их функций и перехода клетки из одного состояния в другое в соответствии с характером возмущающего воздействия. Активация ПОЛ приводит к глубоким нарушениям мембранных структур, к искажению информации от внеклеточных регуляторов к внутриклеточным эффекторным системам, следствием этого является нарушение адаптационных способностей клетки.
Свободные радикалы, образуемые при определенных физиологических условиях и являющиеся потенциально повреждающими агентами, контролируются антиоксидантными защитными механизмами. Недостаточная мощность или дефект в любом из звеньев антиоксидантной защиты становится предпосылкой или причиной чрезмерной активации ПОЛ, поскольку условия, необходимые для усиления ПОЛ, постоянно имеются в живой клетке. В определенной ситуации, когда происходит нарушение баланса между окисленными и восстановленными формами антиоксидантов, возможно возникновение патологических состояний. Увеличение уровня процессов ПОЛ приводит к истощению важных жирных кислот в клетке и усилению протеолиза клеточных ферментов [27].
Процессы ПОЛ играют важнейшую роль в регуляции активности мембраносвязанных ферментов; процессов проницаемости и активного транспорта веществ, транспорта электронов в цепи дыхательных ферментов; рецепции, синтезе и метаболизме эндогенных регуляторов физиологических функций (простагландинов, стероидных гормонов, катехоламинов и т.д.); клеточной дифференцировки и скорости клеточного деления через изменение функциональной активности хроматина; а также многих других биохимических реакций, обусловливающих практически все проявления жизнедеятельности.
Вещества, ингибирующие свободнорадикальное окисление органических соединений молекулярным кислородом, называют антиоксидантами. В связи с этим состояние процессов ПОЛ и система АОЗ имеют существенное значение не только в нормальной физиологии и биохимии клетки и организма в целом, но и могут выступать как ключевое универсальное звено механизмов адаптивных реакций, а также патогенеза различных заболеваний [28].
Поскольку активация перекисного окисления липидов ведет к значительным изменениям в биохимической структуре биологических мембран клеток, то возникает необходимость в присутствии систем, которые непосредственно предотвращали бы действие негативных факторов среды. Соотношение интенсивности процессов свободнорадикального окисления и антиоксидантной защиты определяет так называемый антиоксидантный статус клетки, ткани и организма в целом. Последняя обеспечивает связывание и модификацию свободных радикалов, предупреждение образования и разрушения перекисей, экранирование функциональных групп белков и других биомолекул.
Эффективность антиоксидантной защиты клетки лимитируется тремя факторами: поступлением экзогенных антиоксидантов, уровнем ферментативного окисления углеводов и жиров; активностью пероксидаз, дегидрогеназ и редуктаз, обусловливающих регенерацию антиоксидантов. При срыве системы антиоксидантной защиты (в условиях низкого поступления экзогенных биоантиоксидантов, длительного избыточного введения калоригенных продуктов, облучения или воздействия других факторов) свободнорадикальное окисление в тканях разветвляется лавинообразно.
В настоящий период большое внимание исследователи уделяют изучению повреждающего эффекта продуктов ПОЛ на клетки и ткани организма при действии различных экстремальных факторов. Известно, что одним из важнейших условий оптимальной структурно-функциональной организации клеточных мембран в организме является сбалансированность окислительных процессов и антиоксидантной защиты. Например, усиление процессов ПОЛ вызывает падение активности ферментных и неферментных составляющих антиоксидантной системы и способствует подверженности эритроцитов перекисному гемолизу. При этом на выраженность гемолиза влияют АОА система эритроцита и доступность липидов мембран переокислению. Параллельно с увеличением интенсивности ПОЛ в липидах эритроцитов происходит уменьшение устойчивости эритроцитарных мембран и повреждение самого эритроцита.
На современном этапе развития науки исследованию процессов перекисного окисления липидов придается особое значение в связи с тем, что получено достаточное количество данных о роли ПОЛ как своеобразного регулятора процессов жизнедеятельности. Известно, что свободные радикалы образуются в живом организме в результате процессов естественного метаболизма кислорода, а также в результате нарушений процессов окислительно-восстановительного превращения эндогенных субстратов при воздействии на организм различных экстремальных факторов.
Стационарный уровень липидной пероксидации для нормально метаболизирующих тканей различен и зависит от степени активности тканевых обменных процессов. Для активно метаболизирующих тканей характерен более высокий уровень интенсивности ПОЛ [29]. ПОЛ является важным звеном в регуляции липидного состава биомембран, участвует в регуляции проницаемости и транспорта веществ через мембрану, в транспорте электронов в цепи дыхательных ферментов, в синтезе простагландинов и стероидных гормонов, дифференцировке и скорости клеточных делений.
Увеличение уровня процессов ПОЛ приводит к истощению важных жирных кислот в клетке и усилению протеолиза клеточных ферментов.
Перекисному окислению подвергаются, прежде всего, ненасыщенные жирные кислоты, причем тем быстрее, чем выше степень ненасыщенности. Особенностью липидных компонентов клеточных и субклеточных мембран является наличие в составе их фосфолипидов большого количества ненасыщенных жирнокислотных остатков, особенно чувствительных к пероксидации. Окисление жирнокислотных остатков мембранных фосфолипидов приводит к образованию целого ряда продуктов ПОЛ, обладающих мембранотоксическим действием и играющих важную роль в процессах модификации структуры биологических мембран и их свойств.
Тщательное изучение токсичности окисленных липидов показало, что токсичными для организма являются не столько перекиси, сколько продукты более глубокого окисления липидов - альдегиды, кетоны, кислоты.
При возникновении патологических состояний баланс между процессами образования и расходования перекисей в тканях нарушается и происходит накопление продуктов ПОЛ, приводящее к серьезным нарушениям в биомембранах.
Конечные продукты ПОЛ оказывают токсическое действие на организм за счет сшивки биополимеров, набухания митохондрий и разобщения окислительного фосфорилирования, инактивации тиоловых ферментов, участвующих в тканевом дыхании. Таким образом, избыточное накопление в организме различных продуктов ПОЛ, деструктивно влияющих на биологические мембраны, изменяет активность большого количества ферментов, с нарушением важнейших биохимических процессов в организме.
Все вышесказанное свидетельствует о том, чрезмерное активация процессов ПОЛ ведет к определенному дисбалансу в работе органов и систем, что является предпосылкой возникновению патологических нарушений.
Адаптация организма реализуется посредством развития стрессовой реакции при действии экстремальных факторов. При этом происходит мобилизация функциональной системы, доминирующей в адаптации к конкретному экстремальному фактору и активация неспецифической стресс-реализующей системы с формированием системного структурного следа адаптации.Ведущая роль в этом процессе принадлежит вегетативной нервной системе, функционирующей в тесной связи с эндокринной системой.
Развитие и проявление стресса происходит за счет нарушения потока информации, энергии и вещества, следовательно, и средства коррекции, формирующиеся при стрессе, должны быть многокомпонентными и полифункциональными, затрагивающими нервную, эндокринную, иммунную системы и метаболические процессы. Основным принципом регуляции функций в режиме напряжения является интегративность и дискретность адаптивных изменений функционирования органов, систем и структур, участвующих в адаптации [30].
Таким образом, в организме существует целый ряд взаимосвязанных антиоксидантных систем, основное назначение которых заключается в поддержании реакций свободнорадикального окисления на стационарном уровне. На каждом этапе течения перекисных реакций существует своя специализированная система, осуществляющая эти функции. Часть их строго специфична, как, например, СОД. Другие, как ГЛП, токоферол обладают большой широтой действия и меньшей субстратной специфичностью. Аддитивность взаимодействия ферментативного и неферментативного звеньев системы АОЗ между собой обеспечивает устойчивое протекание свободнорадикальных цепных процессов, поддержание на стационарном уровне активных форм кислорода и эффективный контроль течения процессов перекисного окисления липидов в организме.
Известно, что существенное влияние на профилактический и терапевтический эффект оказывают концентрация и эффективность антиоксидантов. При введении антиоксидантов in vivo может одновременно измениться несколько параметров системы, в том числе и концентрация природных антиоксидантов. Это делает необходимыми исследования общности и различий свойств природных и синтетических антиоксидантов, их взаимоотношения в организме и поиска адекватных критериев определения эффективности используемых антиоксидантов.
Все вышеизложенное свидетельствует о том, что необходимо продолжить дальнейшие научные исследования свойств и практического применения антиоксидантных препаратов, что является весьма важным направлением современных биологических и медицинских исследований.
Научные исследования последних лет, посвященные проблеме влияния антиоксидантов на устойчивость организма к действию экстремальных факторов, говорят о перспективности и значимости исследований в данном направлении.
В свете изложенного, актуальность вопроса о поисках путей предупреждения развития гипогалактии не вызывает сомнения. В настоящее время одним из эффективных подходов по защите женского организма от воздействия неблагоприятных факторов среды является поиск биологически активных препаратов, обладающих антиоксидантными свойствами, и возможность управления процессами повышения устойчивости организма с помощью естественных защитных факторов.
Йод поступает в щитовидную железу в форме ионов, активно поглощаемых клетками фолликулов из крови многочисленных капилляров в определенные фолликулы. Затем эти ионы окисляются до молекулярного йода пероксидазами, и молекулярный йод реагирует с аминокислотой тирозином, входящий в состав тиреоглобулина – белка, выделяемого фолликулярными клетками в просвет фолликула. Дальнейшее кодирование молекул тирозина и последующая их концентрация приводит к образованию двух главных тиреойдных гормонов. Т3 и Т4 оказывают большое влияние на многие метаболические процессы, включая обмен углеводов, белков, жиров и витаминов. Их главное физиологическое свойство состоит в повышении интенсивности основного обмена – в так называемом калоригенном эффекте. Интенсивность основного обмена, составляющая у человека 160 кДж на 1 м2 поверхности тела в 1 час, поддерживается на стабильном уровне тироксином, который способствует расщеплению глюкозы и жиров с образованием легко сгорающих продуктов.
Калоригенный эффект связан с повышением поглощения кислорода и скорости ферментативных реакций, участвующих в транспорте элементов в метохондриях. В конечном результате это приводит к повышенному образованию АТФ и тепла в тканях. Конкретный механизм действия тироксина неизвестен.
Изменения секреции тиреоидных гормонов и нарушения функции щитовидной железы могут происходить в результате поломки биосинтеза тиреоидных гормонов на разных его этапах поступчения йодида из крови, окисления его в элементарныййод,включения йода в состав тирозинов с образованием монойодтирозина и дийодтирозина, конденсации мочекул йодтирозина с образованием Т4 и ТЗ.
Изменения в секреции тиреоидных гормонов и нарушения функции щитовидной железы могут происходить в результате поломки биосинтеза тиреоидных гормонов, приводя к формированию клинических синдромов гипер- и гипотиреоза. Обычно гипертиреоз, независимо от его генеза, характеризуется повышенным содержанием в крови обоих тиреоидных гормонов, хотя известны случаи "ТЗ-тиреотоксикоза" и еще реже "Т4-тиреоктосикоза". ТЗ-тиреотоксикоз (повышенный уровень ТЗ при нормальном Т4) выявляют преимущественно в зонах йодной эндемии у больных с длительно существующим многоузловым зобом, у больных с узловым токсическим зобом, а также у пожилых пациентов с многоузловым зобом. Данный синдром, как правило, является результатом развившейся автономной гиперфункции одного из узлов. ТЗ-тиреотоксикоз - это абсолютное противопоказание для назначения больным с узловым зобом терапии тироксином [31].
T4-тиреотоксикоз (повышенный Т4 при нормальном ТЗ) может встретиться у больных с тяжелыми сопутствующими заболеваниями и у получающих препараты, влияющие на конверсию Т4 в ТЗ.
Гипотиреоз характеризуется сниженным содержанием в крови Т4 и ТЗ, но ТЗ является менее достоверной характеристикой, т.к. его уровень может быть нормальным при легком и среднетяжелом гипотиреозе и, вместе с тем, часто бывает сниженным у больных с нетиреоидной патологией. Изолированное снижение ТЗ при нормальном Т4 и ТТГ не является признаком гипотиреоза.
ТРГ, секретируемый гипоталамусом, проходит в аденогипофиз через портальную систему гипофиза, где он активирует клетки – тиротрофы, ответственные за выработку ТТГ. Секреция ТТГ тормозится с помощью ТРГ по механизму обратной связи, а также под действием других гормонов (в том числе соматостатина и дофамина) и цитокинов, в том числе интерлейкина-1β, интерлейкина-6 и фактора-α некроза опухолей. Действие ТТГ на ткани ЩЖ происходит вследствие активации рецепторов ТТГ, расположенных на поверхности клеток ЩЖ – тироцитов. Рецепторы ТТГ являются трансмембранными рецепторами, семь раз пронизывающими плазматическую мембрану. Через посредство гетеротримерных Gs- и Gq- белков они функционально сопряжены с ферментами, генераторами вторичных посредников – аденилатциклазой (АЦ), катализирующей образование цАМФ, и фосфолипазой С, которая ответственна за синтез 1,4,5-трифосфоинозитола и диацилглицерина, повышающих концентрацию внутриклеточного кальция. Хотя основной путь передачи генерируемого ТТГ сигнала реализуется через 17 АЦСС с участием Gs-белков, передача сигнала через Gq-белки к фосфолипазе С, также играет важную роль в процессах роста ЩЖ и синтеза тиреоидных гормонов (рисунок 4).
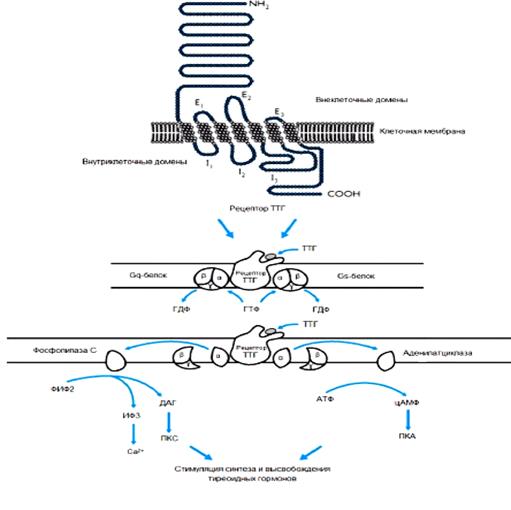
Рисунок 4. Передача сигнала через рецептор ТТГ
Клетки ЩЖ вырабатывают весь пул тироксина (Т4) и 20 % трийодтиронина (T3). Остальные 80 % T3 образуются вследствие конверсии Т4 в Т3, осуществляемой с помощью дейодиназ в ЦНС и периферических тканях. Т4 и Т3 транспортируются в кровь в связанном с белками состоянии. Тиреоидные гормоны, не связанные с белками-переносчиками представляют собой лишь незначительную часть общего пула тиреоидных гормонов, циркулирующих в крови (0.03 % для T4; 0.3 % для T3). Свободный Т3 проникает через плазматическую и ядерную мембраны клеток и специфически взаимодействует с локализованным в ядре Т3-рецептором, функционирующим как транскрипционный фактор. Это взаимодействие приводит к изменению экспрессии генов, кодирующих белки, ответственные за ростовые и метаболические процессы, находящиеся под контролем гормонов ЩЖ. Циркулирующие в крови Т4 и Т3 по механизму обратной связи влияют на способность гипофиза и гипоталамуса контролировать синтез и секрецию ТРГ и ТТГ, что позволяет поддерживать уровень тиреоидных гормонов в крови в пределах нормы.
 2015-05-14
2015-05-14 2516
2516
