Пептиды и белки - представляют собой высокомолекулярные органические соединения, построенные из остатков α - аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником a- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают a- аминокислоты. Многие a- аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков a- аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см.таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки - свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
Конструкция полипептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных (CONH) групп. Различия такой цепи заключаются в боковых радикалах, связанных с метиновой группой, и характеризующих ту или иную аминокислоту. Один конец цепи со свободной аминогруппой называется N– концом, другой, на котором находится аминокислота со свободной карбоксильной группой, называется C– концом. Пептидные и белковые цепи записываются с N– конца. Иногда пользуются специальными обозначениями: на N– конце пишется NH– группа или только атом водорода –H, а на C– конце - либо карбоксильная COOH– группа, либо только гидроксильная OH– группа.
Для полипептидов и белков характерны четыре уровня пространственной организации, которые принято называть первичной, вторичной, третичной и четвертичной структурами.
Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования a- аминокислотных остатков в полипептидной цепи.
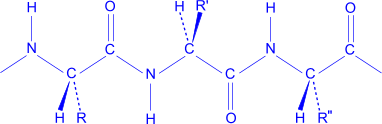
Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – a- спираль.
Третичная структура белка - трехмерная конфигурация закрученной спирали в пространстве, образованная за счет дисульфидных мостиков –S–S– между цистеиновыми остатками и ионных взаимодействий.
Четвертичная структура белка - структура, образующаяся за счет взаимодействия между разными полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
 2015-05-14
2015-05-14 1635
1635
