Рекомендуемая литература: [1], гл. 6, 6.2.8; [2], гл. 5, § 5.5, гл. 6, § 6.1; [5], гл. V.
Химические реакции и физико-химические процессымогут быть необратимыми и обратимыми. Необратимые процессы протекают только в одном направлении и до конца, т.е. до полного расходования хотя бы одного из исходных веществ.
Реакции, которые могут одновременно проходить как в прямом, так и в обратном направлении, называются обратимыми. Обратимые реакции никогда не протекают до конца, т.к. ни одно из реагирующих веществ не расходуется полностью:
аА + вВ ⇄ cC + dD,
где A и B – исходные вещества; C и D – продукты прямой реакции; a, b,c и d – соответствующие стехиометрические коэффициенты.
Состояние химического равновесия устанавливается при равенстве скоростей прямой и обратной реакций: 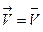 , в соответствии с законом действия масс получаем равенство:
, в соответствии с законом действия масс получаем равенство: 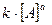 ·
· 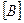
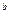 =
= 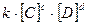 , откуда
, откуда
КР = 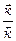 =
= 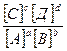
КР – константа равновес ия, выражается через константы скоростей прямой и обратной реакций 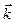
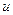
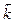 , или через равновесные концентрации реагентов прямой ([A]а·[B]b) и обратной ([C]c·[D]d) реакций. В состоянии равновесия концентрации всех веществ в реакционной системе взаимосвязаны друг с другом, изменение концентрации любого из них вызывает изменение концентрации других. Поэтому соотношение этих концентраций, выражаемое константой равновесия, при данной температуре остается постоянной величиной. Так, для системы: СО2(г) + 4Н2(г) ⇄ СН4(г) + 2Н2О(г) константа равновесия может быть выражена следующим образом:
, или через равновесные концентрации реагентов прямой ([A]а·[B]b) и обратной ([C]c·[D]d) реакций. В состоянии равновесия концентрации всех веществ в реакционной системе взаимосвязаны друг с другом, изменение концентрации любого из них вызывает изменение концентрации других. Поэтому соотношение этих концентраций, выражаемое константой равновесия, при данной температуре остается постоянной величиной. Так, для системы: СО2(г) + 4Н2(г) ⇄ СН4(г) + 2Н2О(г) константа равновесия может быть выражена следующим образом:
КР = 
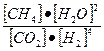


Физический смысл константы равновесия определяется соотношением констант скоростей прямой и обратной реакций 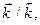 и показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции при одинаковой концентрации всех веществ в системе, равной единице, и данной постоянной температуре. Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации и присутствия катализаторов.
и показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции при одинаковой концентрации всех веществ в системе, равной единице, и данной постоянной температуре. Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации и присутствия катализаторов.
Смещением или сдвигом равновесия называется процесс изменения равновесных концентраций веществ, вызванный нарушением равновесия. Состояние химического равновесия может существовать сколь угодно долго, но нарушается при изменении концентраций реагирующих веществ и продуктов реакций, температуры и давления (последнее – только для газообразных веществ). Все эти параметры влияют на скорость реакции. Таким образом, чтобы нарушить состояние химического равновесия, необходимо изменить скорости прямой или обратной реакций и тем самым нарушить их равенство.
Для смещения равновесия и, как следствие, управления направленностью обратимого процесса может быть использован принцип подвижного равновесия  (принцип Ле Шателье):
(принцип Ле Шателье):
Изменение одного из условий в равновесной системе (температуры, давления, концентрации) вызывает смещение химического равновесия в направлении того процесса, который противодействует произведенному изменению.
Так, в системе СН4(Г) + СО2(Г) ⇄ 2СО(Г) + 2Н2(Г), ΔΗ>0 равновесие смещается вправо, т.е. в направлении прямой реакции в следующих случаях:
– при повышении температуры, т.к. при этом равновесие должно смещаться в сторону эндотермического процесса;
– при увеличении концентрации метана и (или) оксида углерода (IV) или при уменьшении концентрации оксида углерода (II) и водорода, что вытекает из закона действия масс;
– при понижении давления в системе, поскольку количество газообразных молекул продуктов прямой реакции преобладает над количеством молекул исходных веществ.
В случае реакции, протекающей в растворе, процесс обратим, если хотя бы один реагент и один продукт реакции проявляют свойства слабого электролита. Например, в обратимой реакции гидролиза ацетата калия СН3СООК + Н2О ⇄ СН3СООН + КОН, ΔΗ>0 реагентами – слабыми электролитами являются: в прямой реакции – вода, в обратной реакции нейтрализации – уксусная кислота. При этом равновесие смещено в сторону образования более слабого электролита – воды, т.е. влево. Для смещения равновесия вправо следует увеличить концентрацию воды (разбавить раствор), уменьшить концентрацию КОН (путем добавления кислоты, связывающей образующиеся при гидролизе ионы ОН¯), повысить температуру (поскольку реакция гидролиза эндотермична). Изменением давления невозможно сместить равновесие в данной реакции, т.к. в ней не участвуют газообразные вещества.
 2015-05-14
2015-05-14 1557
1557
