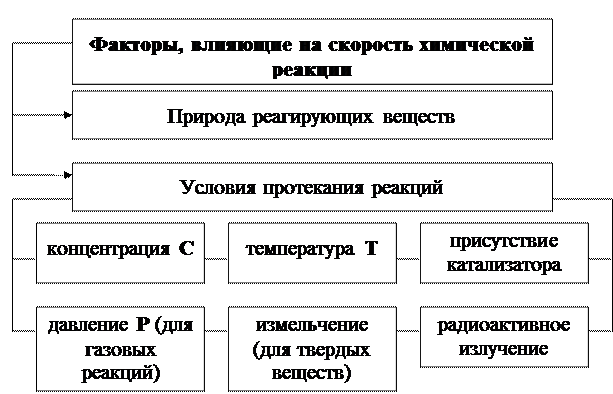
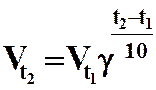| Учение о скоростях и механизмах химических реакций называется химической кинетикой.
|
| Под скоростью химической реакциипонимают изменения концентрации одного из реагирующих веществ в единицу времени в единице объема для гомогенной (однородной) системы и на границе раздела фаз для гетерогенной системы.
|
| Фаза – совокупность всех однородных частей системы, обладающих одинаковым химическим составом и одинаковыми свойствами.
|
| Гомогенные системы – системы, состоящие из одной фазы. Реакции, протекающие в ней, называются гомогенными. Химическая реакция в гомогенных системах протекает по всему объёму системы.
| Гетерогенные системы –системы, содержащие две и более число фаз. Реакции, протекающие в них, называются гетерогенными. Реакции в гетерогенных системах протекают на поверхности раздела фаз.
|
| Например:
2NH3 + 3Cl2 = 6HCl + N2
(все вещества находятся в газообразном состоянии)
2KOH + H2SO4 = K2SO4 + 2H2O
(все вещества находятся в жидком растворе)
| Например:
CO2(газ) + С(тв) = 2СО(газ)
(реакция протекает на поверхности углерода)
Mg(тв) + 2HCl(ж) = MgCl2(ж) + Н2(газ)
(реакция протекает на поверхности магния)
|
| Обратимость химических реакций
|
| Все химические реакции можно разбить на две группы: необратимыеи обратимые реакции.
|
| Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ.
| Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция может протекать как в прямом, так и в обратном направлениях.
|
| Например:
Zn(тв) + 2HCl(ж) = ZnCl2(ж) + H2(газ)
| Например:
N2(газ) + 3Н2(газ) ↔ 2NH3(газ)
|
| Основные законы химической кинетики
|
| Зависимость скорости от концентрации определяется законом действия масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их коэффициентов в уравнении реакций.
|
| Для обратимой реакции: аА + bВ ↔ сС + dD
υпр = kпр•C(A)a•C(B)b,
υобр = kобр•С(C)c•C(D)d,
где υпр., υобр. – скорости прямой и обратной реакций, моль/л∙с;
|
| C(А), C(B), С(C), C(D)– концентрации веществ А, В, С, D, моль/л;
|
| kпр, kобр – константы скорости прямой и обратной химической реак ции, которые зависят от химической природы реагирующих веществ, температуры и наличия катализатора;
|
| a, b, c, d – стехиометрические коэффициенты в уравнении реакций.
|
| Например, для гомогенной обратимой системы:
2SO2 + O2 = 2SO3:
выражения скоростей реакции будет:υпр. = kпр•C2(SO2)•C(O2);
υобр. = kобр•С2(SO3).
| Например, для гетерогенной реакции: 3Fe(к)+4Н2О(газ)=Fe3O4(тв)+4Н2(газ) выражения скоростей реакции
будет: υпр. = kпр•C4(Н2О);
υобр. = kобр•С4(Н2).
|
| Химическое равновесие –термодинамическое равновесие в системе, в которой возможны прямые и обратные химические реакции. При химическом равновесии скорости всех реакций в двух противоположных направлениях равны между собой, поэтому в системе не наблюдается изменений макроскопических параметров, в том числе концентраций реагирующих веществ. Количественной характеристикой химического равновесия является константа равновесия (Кравн.).
|
Для обратимой реакции в состоянии равновесия:
аА + b В ↔ сС + dD,
Vпр = Vобр,
kпр•[А]a•[В]b = kобр•[С]c•[D]d,
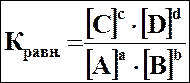 . .
|
Например, для гомогенной реакции N2 +3H2 = 2NH3 константа равновесия будет равна:
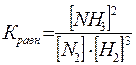 , ,
| Например, для гетерогенной реакции
3 Fe(тв) +4Н2О(г) = Fe3O4(тв) + 4Н2(г) 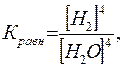
|
| где [NH3], [N2], [Н2], [Н2О] – концентрации веществ в состоянии равновесия (равновесные концентрации), моль/л.
|
| | | |
| Изменение условий
| Направление смещения
|
| Температура
| ↑ повышение
| Смещается в сторону эндотермической реакции (∆Н˚>0).
|
| ↓ понижение
| Смещается в сторону экзотермической реакции (∆Н˚<0).
|
| Давление
| ↑ повышение
| Равновесие реакции между газами смещается в сторону реакции, идущей с уменьшением объема.
|
| ↓ понижение
| Равновесие реакции между газами смещается в сторону реакции, идущей с увеличением объема.
|
| Концентрация
исходных
веществ
| ↑ повышение
| Равновесие смещается в сторону продукта реакции.
|
| ↓ понижение
| Равновесие смещается в сторону исходных веществ.
|
|
Например, как следует изменить температуру, давление и концентрацию исходных веществ в системе
ZnS(тв)+3О2 (г) → 2ZnO(тв)+2SO2 (г), ∆Н˚<0,
чтобы повысить выход оксида цинка?
Ответ: согласно принципу Ле-Шателье температуру необходимо понизить, т.к. реакция экзотермическая; давление повысить, т.к. реакция идет с уменьшением числа газовых фаз; концентрацию исходных веществ увеличить.
|
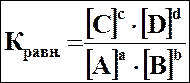 .
.
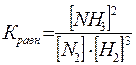 ,
,
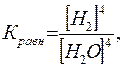
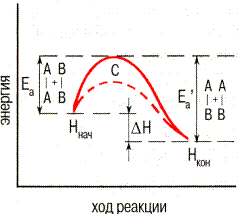 Необходимо преодолеть энергетический барьер С.
Необходимо преодолеть энергетический барьер С.
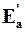 – энергия активации обратной реакции
– энергия активации обратной реакции


 2015-04-01
2015-04-01 639
639