Изохорный процесс(V = const; dV = 0). Так как dV = 0, то работа при изохорном процессе 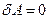 . Из первого закона термо- динамики следует, что
. Из первого закона термо- динамики следует, что

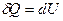 , (3.8)
, (3.8)
то есть при изохорном процессе поступающая извне теплота 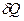 идёт только на приращение внутренней энергии dU системы. Учитывая, что
идёт только на приращение внутренней энергии dU системы. Учитывая, что 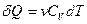 , получаем
, получаем
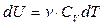 , (3.9)
, (3.9)
CV – молярная теплоёмкость при постоянном объеме.
Сопоставляя (3.5) и (3.9), найдем СV
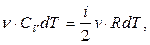
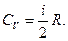
(3.10)
Изобарный процесс(P = const, dP = 0). Передаваемое газу количество теплоты идёт на изменение его внутренней энергии и на совершение им работы при постоянном давлении:
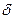 Q = dU +
Q = dU + 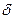 A. (3.11)
A. (3.11)
Пользуясь уравнением состояния, получим
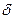 A = pdV = vRdT
A = pdV = vRdT
Тогда, учитывая соотношение (3.9) и что 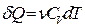 , перепишем уравнение (3.11) в виде:
, перепишем уравнение (3.11) в виде:
vCp dT = vСV dT + vRdT,
откуда
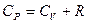 . (3.12)
. (3.12)
Это выражение называют уравнением Майера.
Из уравнения (3.12) следует, что C p> C v, 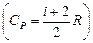 .
.
При одном и том же 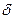 Q, изменение температуры dT при изобарном процессе меньше, чем при изохорном, и, следова- тельно, теплоемкость больше.
Q, изменение температуры dT при изобарном процессе меньше, чем при изохорном, и, следова- тельно, теплоемкость больше.
Изотермический процесс(T = const, dT = 0).
Так как dT = 0, то внутренняя энергия системы при изо- термическом процессе не изменяется, и вся поступающая извне теплота идёт на совершение системой работы:
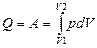 . (3.13)
. (3.13)
Учитывая, что согласно уравнению состояния идеального газа,
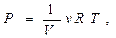
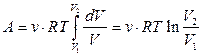 получим
получим
. (3.14)

 2015-05-14
2015-05-14 660
660








